Мелиоидоз - Melioidosis - Wikipedia
| Мелиоидоз | |
|---|---|
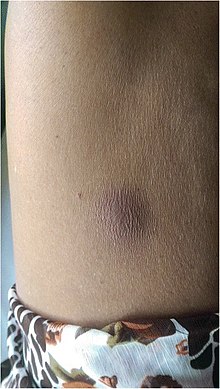 | |
| Мелиоидозный абсцесс на животе | |
| Специальность | Инфекционное заболевание |
| Симптомы | Нет, жар, пневмония, несколько абсцессы[1] |
| Осложнения | Энцефаломиелит, септический шок, острый пиелонефрит, септический артрит, остеомиелит[1] |
| Обычное начало | 1-21 день после заражения[1] |
| Причины | Burkholderia pseudomallei распространяется при контакте с почвой или водой[1] |
| Факторы риска | Сахарный диабет, талассемия, алкоголизм, хроническая болезнь почек[1] |
| Диагностический метод | Выращивание бактерий в питательных средах[1] |
| Дифференциальная диагностика | Туберкулез[2] |
| Профилактика | Предотвращение воздействия загрязненной воды, профилактика антибиотиками[1] |
| Уход | Цефтазидим, меропенем, ко-тримоксазол[1] |
| Частота | 165000 человек в год[1] |
| Летальные исходы | 89000 человек в год[1] |
Мелиоидоз является инфекционное заболевание вызвано Грамотрицательный бактерия называется Burkholderia pseudomallei.[1] Большинство людей инфицированы Б. pseudomallei не испытывают никаких симптомов, но у тех, у кого есть симптомы, есть признаки и симптомы, которые варьируются от легких, таких как высокая температура, изменения кожи, пневмония, и абсцессы, чтобы серьезно воспаление головного мозга, воспаление суставов, и опасно низкое кровяное давление что вызывает смерть.[1] Приблизительно у 10% людей с мелиоидозом развиваются симптомы, которые длятся более двух месяцев, называемые «хроническим мелиоидозом».[1]
Люди заражены Б. pseudomallei при контакте с загрязненной водой. Бактерии попадают в организм через раны, вдыхание или проглатывание. Передача от человека к человеку или от животного человеку происходит крайне редко.[1] Инфекция постоянно присутствует в Юго-Восточной Азии, особенно на северо-востоке. Таиланд и северная Австралия.[1] В развитых странах, таких как Европа и США, случаи мелиоидоза обычно завозятся из стран, где мелиоидоз более распространен.[3] Признаки и симптомы мелиоидоза напоминают туберкулез и неправильный диагноз - обычное дело.[2] Диагноз обычно подтверждается ростом Б. pseudomallei из крови или других телесных жидкостей инфицированного человека.[1] Пациентов с мелиоидозом сначала лечат «интенсивным» курсом внутривенных антибиотиков (чаще всего цефтазидим ) с последующим курсом лечения в течение нескольких месяцев ко-тримоксазол.[1] Даже при правильном лечении около 10% людей с мелиоидозом умирают от этого заболевания. Если заболевание лечить неправильно, смертность может достигнуть 40%.[1]
Меры по предотвращению мелиоидоза включают ношение защитного снаряжения при обращении с зараженной водой, соблюдение гигиены рук, употребление кипяченой воды и избегание прямого контакта с почвой, водой или сильным дождем.[1] В антибиотик Ко-тримоксазол используется в качестве профилактического средства только для лиц с высоким риском заражения после контакта с бактериями.[1] Вакцина от мелиоидоза не одобрена.[1]
Примерно 165 000 человек заражаются мелиоидозом в год, что приводит к примерно 89 000 смертельных исходов.[1] Сахарный диабет является основным фактором риска мелиоидоза; более половины случаев мелиоидоза приходится на людей с диабетом.[1] Увеличение количества осадков связано с увеличением числа случаев мелиоидоза в эндемичный области.[2] Заболевание впервые было описано Альфред Уитмор в 1912 г. в настоящее время Мьянма.[4]
Признаки и симптомы
Острый




Большинство людей подвергаются Б. pseudomallei не испытывают никаких симптомов.[2] Около 85% инфицированных страдают острым мелиоидозом.[5] Значение период инкубации острый мелиоидоз составляет 9 дней (от 1 до 21 дня).[1] Тем не менее, симптомы мелиоидоза могут проявиться через 24 часа у тех, кто чуть не утонул в воде.[5] Пострадавшие имеют симптомы сепсис (преимущественно лихорадка) с или без пневмония, или локализованный абсцесс или другой очаг инфекции. Наличие неспецифических признаков и симптомов привело к тому, что мелиоидоз получил прозвище «великий подражатель».[1]
Люди с сахарный диабет или регулярное воздействие бактерий повышают риск развития мелиоидоза. Заболевание следует рассматривать у тех, кто живет в эндемичных районах, у которых развивается лихорадка, пневмония или абсцессы в печени, селезенке, простате или околоушных железах.[1] Клинические проявления болезни могут варьироваться от простых изменений кожи до серьезных проблем с органами.[1] Кожные изменения могут быть неспецифическими абсцессами или изъязвлениями.[6] В северной Австралии у 60% инфицированных детей были только кожные поражения, а у 20% - пневмония.[3] Чаще всего поражаются печень, селезенка, легкие, простата и почки. Среди наиболее частых клинических признаков: наличие бактерий в крови (в 40-60% случаев), пневмонии (50%) и септический шок (20%).[1] У людей только с пневмонией может быть сильный кашель с мокротой и одышкой. Однако у людей с септическим шоком и пневмонией кашель может быть минимальным.[2] Результаты рентгенографии грудной клетки могут варьироваться от диффузных узловых инфильтратов у пациентов с септическим шоком до прогрессирующих. затвердение легких в верхние доли только для больных пневмонией. Избыток жидкости в плевральной полости и скопление гноя в полости чаще встречаются при мелиоидозе, поражающем нижние доли легких.[2] В 10% случаев после первичной инфекции у людей развивается вторичная пневмония, вызванная другими бактериями.[3]
В зависимости от течения инфекции развиваются другие тяжелые проявления. От 1 до 5% инфицированных развиваются воспаление головного мозга и головного мозга или же скопление гноя в головном мозге; От 14 до 28% развиваются бактериальное воспаление почек, абсцесс почки или абсцессы простаты; От 0 до 30% развивается шея или слюнных желез абсцессы; От 10 до 33% развиваются абсцессы печени, селезенки или паракишечные абсцессы; От 4 до 14% развиваются септический артрит и остеомиелит.[1] К редким проявлениям относятся: заболевание лимфатических узлов напоминающий туберкулез,[7] средостение массы скопление жидкости в сердечном покрытии,[3] аномальное расширение кровеносных сосудов из-за инфекции,[1] и воспаление поджелудочной железы.[3] В Австралии до 20% инфицированных мужчин заболевают абсцессом предстательной железы, характеризующимся: боль при мочеиспускании, затрудненное мочеиспускание и задержка мочи требующий катетеризация.[1] Ректальное обследование показывает воспаление предстательная железа.[3] В Таиланде у 30% инфицированных детей развиваются околоушные абсцессы.[1] Энцефаломиелит может возникнуть у здоровых людей без факторов риска. Пациенты с мелиоидозным энцефомиелитом обычно имеют нормальный компьютерная томография сканирований, но увеличено Сигнал T2 к магнитно-резонансная томография, распространяясь на мозговой ствол и спинной мозг. Клинические признаки включают: односторонние верхний двигательный нейрон слабость конечностей, признаки мозжечка, параличи черепных нервов (VI, VII нервные параличи и бульбарный паралич ). Некоторые случаи представлены с вялый паралич один.[3] В северной Австралии у всех случаев мелиоидоза с энцефаломиелитом были повышенные лейкоциты в спинномозговая жидкость (CSF), в основном мононуклеарные клетки с повышенным содержанием белка ЦСЖ.[7]
Хронический
Хронический мелиоидоз обычно определяется симптомами, длящимися более двух месяцев, и встречается примерно у 10% пациентов.[1] Клинические проявления включают лихорадку, потерю веса и продуктивный кашель с кровянистой мокротой или без нее, что может имитировать туберкулез. Кроме того, также могут присутствовать давние абсцессы на нескольких участках тела.[2] Следует учитывать туберкулез, если лимфатические узлы увеличены в корень легкого. Пневмония, вызванная мелиоидозом, редко вызывает рубцевание и кальцификацию легких, в отличие от туберкулеза.[7]
Скрытый
При скрытой инфекции иммунокомпетентный люди могут избавиться от инфекции, не проявляя никаких симптомов, но менее 5% всех случаев мелиоидоза имеют активацию после периода латентности.[1] У пациентов со скрытым мелиоидозом симптомы могут отсутствовать в течение десятилетий.[8] Первоначально считалось, что наибольший период между предполагаемым воздействием и клиническими проявлениями составлял 62 года за заключенный войны в Бирме-Таиланде-Малайзии.[8] Однако последующее генотипирование бактериального изолята, полученного от ветерана Вьетнама, показало, что изолят, возможно, был получен не из Юго-Восточная Азия, но из Южной Америки.[9] Это подтверждает другое сообщение, согласно которому самый длительный латентный период мелиоидоза составляет 29 лет.[10] Возможность длительной инкубации была признана военнослужащими США, участвовавшими во Вьетнамской войне, и получила название «Вьетнамская бомба замедленного действия».[2] В Австралии самый длинный зарегистрированный латентный период составляет 24 года.[3] Различные сопутствующие заболевания, такие как диабет, почечная недостаточность и алкоголизм, могут предрасполагать к реактивации мелиоидоза.[2]
Причина
Бактерии
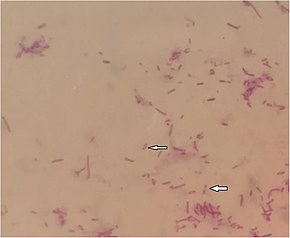
Мелиоидоз вызывается грамотрицательными, подвижными, сапрофитный названная бактерия Burkholderia pseudomallei.[1] Бактерии также могут быть оппортунистический, факультативный внутриклеточный патогены.[1] Это также аэробика и оксидазный тест положительный.[2] Вакуоль в центре бактерии при окрашивании по Граму делает ее похожей на «английскую булавку».[2] Бактерии издают сильный запах почвы через 24-48 часов роста в культуре. Б. pseudomallei производит гликокаликс полисахарид капсула, которая делает его устойчивым ко многим видам антибиотиков.[11] Обычно устойчив к гентамицин и колистин, но чувствителен к амоксициллин / клавулановая кислота (со-амоксиклав). Б. pseudomallei это уровень биобезопасности 3 патоген, требующий специализированной лабораторной обработки.[2] У животных другой похожий организм, названный Burkholderia mallei является возбудителем болезни сап.[1] Б. pseudomallei можно отличить от других близкородственных, но менее патогенных видов, Б. thailandensis, благодаря способности ассимилировать арабиноза.[7] Б. pseudomallei легко адаптируется к различным средам хоста изнутри микоризные грибы споры в амебы.[2] Его приспособляемость может дать ему преимущество в выживании в организме человека.[1]
Геном Б. pseudomallei состоит из двух репликоны: хромосома 1 кодирует хозяйственные функции бактерий, таких как синтез клеточной стенки, подвижность и метаболизм; хромосома 2 кодирует функции, которые позволяют бактериям адаптироваться к различным средам. Горизонтальный перенос генов среди бактерий привело к очень вариабельным геномам в Б. pseudomallei. Австралия была предложена как ранний резервуар для Б. pseudomallei из-за высокой генетической изменчивости бактерий, обитающих в этом регионе. Бактерии, изолированные из Африки, Центральной и Южной Америки, похоже, имеют общего предка, жившего в 17-19 веках.[1] B. mallei это клон Б. pseudomallei который потерял значительную часть своего генома, поскольку он приспособился жить исключительно среди млекопитающих.[3]
Передача инфекции
Б. pseudomallei Обычно встречается в почве и поверхностных водах, и наиболее распространен на глубине почвы от 10 до 90 см.[1] Он был обнаружен в почвах, прудах, ручьях, бассейнах, стоячей воде и рисовых полях.[2] Он может выжить в условиях с низким содержанием питательных веществ, таких как дистиллированная вода, почва пустыни и почва, обедненная питательными веществами, более 16 лет.[1] Он также может выжить в растворах антисептиков и моющих средств, в кислой среде (pH 4.5 в течение 70 дней) и окружающей среде при температуре от 24 до 32 ° C (от 72 до 89,6 ° F). Бактерии не выживают в ультрафиолетовом свете.[1]
Бактерии могут попасть в организм через раны, вдыхание и проглатывание загрязненной воды.[1] Передача от человека к человеку происходит крайне редко.[2] Мелиоидоз - признанное заболевание у животных, включая кошек, собак, коз, овец и лошадей. Считается, что крупный рогатый скот, буйволы и крокодилы относительно устойчивы к мелиоидозу, несмотря на их постоянное воздействие зараженной воды и почвы. Птицы также устойчивы к мелиоидозу. [7][11] Передача от животных человеку редко.[1][2]
Неадекватный хлорирование водоснабжения были связаны с Б. pseudomallei вспышка в Северной и Западной Австралии. Бактерии также были обнаружены в нехлорированной воде в сельских районах Таиланда. Оросительная жидкость загрязнена B pseudomallei связан с нозокомиальный раневая инфекция в больницах.[1] Основываясь на секвенировании всего генома бактерий, люди могут играть роль в перемещении Б. pseudomallei с места на место.[12]
Патогенез
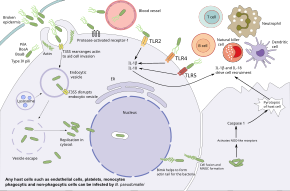
Б. pseudomallei обладает способностью инфицировать различные типы клеток и уклоняться от иммунных реакций человека. Бактерии сначала попадают при разрыве кожных покровов или слизистая оболочка и реплицируются в эпителиальных клетках. Оттуда они используют жгутиковый подвижность к распространению и заражению различных типов клеток. В кровотоке бактерии могут инфицировать как фагоциты и нефагоциты. Б. pseudomallei использует жгутики, чтобы приблизиться хозяин клетки, а затем прикрепляется к клеткам с помощью различных белков адгезии, включая пилус IV типа белок PilA и белки адгезии BoaA и BoaB. Кроме того, адгезия бактерий частично зависит от присутствия белка-хозяина. рецептор-1, активируемый протеазой, который присутствует на поверхности эндотелиальные клетки, тромбоциты, и моноциты. После связывания бактерии проникают в клетки-хозяева через эндоцитоз, попадая в эндоцитоз везикул. Поскольку везикула подкисляется, Б. pseudomallei использует свой система секреции типа 3 (T3SS) для введения эффекторных белков в клетку-хозяина, разрушения везикулы и позволяя бактериям проникнуть в хозяина цитоплазма. Внутри цитоплазмы хозяина бактерии избегают уничтожения хозяином. аутофагия с использованием различных эффекторных белков T3SS. Бактерии размножаются в цитоплазме хозяина.[1][7]
Внутри клетки-хозяина бактерии перемещаются, вызывая полимеризацию хозяина. актин позади них, продвигая бактерии вперед.[1] Эта опосредованная актином подвижность достигается за счет автовоз BimA, который взаимодействует с актином в хвостовой части бактерии. Под действием актина бактерии толкают мембрану хозяина, создавая выступы, которые распространяются на соседние клетки. Эти выступы заставляют соседние клетки сливаться, что приводит к образованию многоядерные гигантские клетки (MNGC). Когда MNGC лизируются, они образуют бляшки (центральная прозрачная область с кольцом слитых клеток), которые обеспечивают укрытие для бактерий для дальнейшей репликации или скрытая инфекция. Тот же самый процесс в инфицированных нейронах может позволить бактериям проходить через нервные корешки в спинном и головном мозге, что приводит к воспаление головного и спинного мозга. Помимо распространения от клетки к клетке, бактерии также могут распространяться через кровоток, вызывая сепсис. Бактерии могут выжить в антигенпрезентирующие клетки и дендритные клетки. Таким образом, эти клетки действуют как носители, переносящие бактерии в лимфатическую систему, вызывая широкое распространение бактерий в организме человека.[1][7]
Пока Б. pseudomallei могут выжить в фагоцитарных клетках, эти клетки могут убивать Б. pseudomallei несколькими механизмами. Макрофаги активируются интерферон гамма улучшили убийство Б. pseudomallei через производство индуцибельная синтаза оксида азота. Подкисление эндосомы и разложение бактерий также возможно, однако бактериальная капсула и ЛПС делают Б. pseudomallei устойчив к лизосомной деградации. Один раз Б. pseudomallei ускользает в цитозоль хозяина, он может быть распознан рецепторы распознавания образов Такие как NOD-подобные рецепторы, инициируя формирование воспаление и активация каспаза 1, что вызывает гибель клетки-хозяина пироптоз и дальнейшая активация иммунной системы. Некоторые системные защиты хозяина также способствуют иммунному ответу. Б. pseudomallei запускает как система комплемента и каскад коагуляции, однако толстая бактериальная капсула препятствует действию комплекс атак на мембрану комплемента.[1][7]
Дополнительные элементы иммунной системы активируются хозяином толл-подобные рецепторы такие как TLR2, TLR4 и TLR5, которые распознают консервированные кусочки бактерий, таких как ЛПС и жгутики. Эта активация приводит к производству цитокины Такие как интерлейкин 1 бета (IL-1β) и интерлейкин 18 (Ил-18). IL-18 увеличивает производство IFN за счет естественные клетки-киллеры, в то время как IL-1beta снижает продукцию IFN. Эти иммунные молекулы стимулируют набор других иммунных клеток, таких как нейтрофилы, дендритные клетки, В-клетки, и Т-клетки к месту заражения. Т-клетки кажутся особенно важными для контроля Б. pseudomallei; Количество Т-клеток увеличивается у выживших, а низкое количество Т-клеток связано с высоким риском смерти от мелиоидоза. Несмотря на это, ВИЧ-инфекция не является фактором риска мелиоидоза. Хотя макрофаги демонстрируют нарушенную регуляцию цитокин Ответы у людей с ВИЧ-инфекцией, интернализация бактерий и внутриклеточное уничтожение все еще эффективны. Люди заражены Б. pseudomallei вырабатывают антитела против бактерий, а люди, живущие в эндемичных районах, как правило, имеют в крови антитела, распознающие Б. pseudomallei, но эффективность этих антител в предотвращении мелиоидоза неясна.[1][7]
Б. pseudomallei может оставаться в латентном состоянии в организме человека от 19 до 29 лет, пока не активируется во время иммуносупрессия или стрессовая реакция. Местонахождение бактерий во время скрытой инфекции и механизм, с помощью которого они избегают иммунного распознавания в течение многих лет, неясны. Среди предлагаемых механизмов - пребывание в ядре клетки для предотвращения переваривания, перехода в стадию более медленного роста, устойчивости к антибиотикам и генетической адаптации к среде хозяина. Гранулемы (содержащие нейтрофилы, макрофаги, лимфоциты и многоядерные гигантские клетки), образующиеся в очаге инфекции при мелиоидозе, были связаны с латентной инфекцией у людей.[1]
Диагностика



Бактериальный посев - окончательный диагноз мелиоидоза. Б. pseudomallei никогда не является частью человеческой флоры. Следовательно, любой рост бактерий является диагностическим признаком мелиоидоза. Культуры крови являются наиболее распространенными образцами для диагностики, поскольку бактерии могут быть обнаружены в крови в 50–60% случаев мелиоидоза. Другие образцы, такие как мазки из горла, ректальные мазки, гной из абсцессов и мокрота, также могут использоваться для посева. Если бактерии не растут у людей, у которых есть серьезные подозрения на мелиоидоз, следует проводить повторные посевы, так как последующие посевы могут стать положительными.[1] Б. pseudomallei можно выращивать на агаре с овечьей кровью, МакКонки агар, Среда Эшдауна (содержащий гентамицин ),[1] или бульон Эшдауна (содержащий колистин ).[3] Чашки с агаром для мелиоидоза следует инкубировать при 37 ° C (98,6 ° F) на воздухе. [2] и осматривали ежедневно в течение четырех дней. На чашках с агаром Б. pseudomallei образует кремообразную, негемолитический, колонии через 2 дня инкубации. Через 4 дня инкубации колонии выглядят сухими и морщинистыми.[1] Колонии Б. pseudomallei растения, выращенные на среде Фрэнсиса (модификация среды Эшдауна с увеличением концентрации гентамицина до 8 мг / л), имеют желтый цвет. Для лабораторий, расположенных за пределами эндемичных районов, Burkholderia cepacia селективный агар или Псевдомонады селективный агар можно использовать, если среда Эшдауна недоступна.[2] Важно не истолковать рост бактерий как Псевдомонады или же Бациллы виды Другие инструменты биохимического скрининга также могут быть использованы для выявления Б. pseudomallei, в том числе Биохимический набор API 20NE или 20E в сочетании с окраской по Граму, оксидазный тест, типичные характеристики роста и устойчивость бактерий к определенным антибиотикам.[3] Молекулярные методы, такие как пробы 16S рДНК и полимеразной цепной реакции также может использоваться для обнаружения Б. pseudomallei в культуре, но они доступны только в исследовательских и справочных лабораториях.[1]
Общие анализы крови у людей с мелиоидозом показывают низкое количество лейкоцитов (указывает на инфекцию), повышенные ферменты печени, повышенное билирубин уровни (указывает на дисфункцию печени) и повышенный уровень мочевины и креатинина (указывает на дисфункцию почек). Низкий уровень глюкозы в крови и ацидоз предсказывает худший прогноз у больных мелиоидозом. Однако другие тесты, такие как С-реактивный белок и прокальцитонин уровни не являются надежными в прогнозировании тяжести инфекции мелиоидоза.[11]
Под микроскопом Б. pseudomallei рассматривается как грамотрицательный и палочковидный с биполярным окрашиванием, похожим по внешнему виду на английскую булавку. Бактерии иногда можно увидеть непосредственно в клинических образцах инфицированных людей, но идентификация с помощью световой микроскопии не является ни тем, ни другим. специфический или чувствительный. Иммунофлуоресцентная микроскопия является высокоспецифичным для обнаружения бактерий непосредственно из клинических образцов, но имеет чувствительность менее 50%.[1][3] Иммуноферментный анализ латерального потока был разработан, но не получил широкой оценки.[1][3] Все большее количество лабораторий используют Матричная лазерная десорбция / ионизация масс-спектрометрия для точной идентификации бактерий.[7]
Серологические тесты такие как косвенные гемагглютинация были использованы для обнаружения наличия антител против Б. pseudomallei. Однако у разных групп людей уровни антител сильно различаются, поэтому интерпретация этих тестов зависит от местоположения. В Австралии менее 5% людей имеют Б. pseudomallei антител, поэтому присутствие даже относительно небольших количеств антител необычно и может указывать на мелиоидоз. В Таиланде у многих людей есть антитела против Б. pseudomallei, поэтому только относительно высокое количество антител в крови указывает на мелиоидоз.[1][3] Таиланд также использует прямой иммунофлуоресцентный тест на антитела (IFAT) и латексная агглютинация. В IFAT оба Б. pseudomallei антиген и Б. thailandensis может использоваться для количественного определения количества антител, продуцируемых против бактерий. Следовательно, результаты следует интерпретировать с осторожностью, поскольку может быть обнаружена ложноположительная реакция, если кто-то ранее подвергался воздействию непатогенных Б. thailandensis.[2] Латексная агглютинация полезен при скрининге подозреваемых Б. pseudomallei колонии.[1] Коммерческий ELISA наборы для лечения мелиоидоза больше не доступны на рынке из-за низкой чувствительности к обнаружению человеческих антител.[7]
Различные методы визуализации также могут помочь в диагностике мелиоидоза. При остром мелиоидозе с распространением бактерий через кровоток рентгенограмма грудной клетки показывает мультифокальные узловые поражения. Также могут быть видны сливающиеся узелки или кавитации. У пациентов с острым мелиоидозом без распространения в кровоток рентгенография грудной клетки показывает верхнюю долю укрепление или кавитации. При хроническом мелиоидозе медленное прогрессирование уплотнения верхней доли легких напоминает туберкулез. При абсцессах, расположенных в других частях тела, кроме легких, особенно в печени и селезенке, CT сканирование имеет более высокую чувствительность по сравнению с ультразвуковым сканированием. При абсцессах печени и селезенки ультразвуковое сканирование показывает «мишенеподобные» поражения, в то время как компьютерная томография показывает «сотовый знак» при абсцессах печени. При мелиоидозе головного мозга МРТ имеет более высокую чувствительность, чем компьютерная томография, при диагностике поражения. МРТ показывает поражения с усилением кольца при мелиоидозе мозга.[7]
Профилактика
Мелиоидоз - это подлежащая уведомлению болезнь в Австралии. Это позволяет стране отслеживать бремя болезней и сдерживать вспышки. Мелиоидоз является заболеванием, подлежащим уведомлению в Таиланде только с июня 2016 года. Тем не менее, Австралия также приступила к информационным кампаниям, чтобы повысить осведомленность населения о болезни.[7] В Соединенных Штатах сотрудники лабораторий могут работать с клиническими образцами Б. pseudomallei под BSL-2 условий, а массовое производство таких организмов требует BSL-3 меры предосторожности.[13] Также сообщалось о нескольких случаях госпитальной инфекции мелиоидоза, поэтому работникам здравоохранения рекомендуется соблюдать гигиену рук и универсальные меры предосторожности.[1]
Крупномасштабное хлорирование воды позволило снизить Б. pseudomallei в воде в Австралии. В странах со средним и низким уровнем доходов воду следует кипятить перед употреблением. В странах с высоким уровнем доходов воду можно обрабатывать ультрафиолетом для тех, кто подвержен риску заражения мелиоидозом. Тем, кто подвержен высокому риску контакта с бактериями, следует надевать защитную одежду (например, обувь и перчатки) во время работы. Тем, кто живет в эндемичных районах, следует избегать прямого контакта с почвой, а также воздействия сильного дождя или пылевых облаков на открытом воздухе. Для питья предпочтительнее бутилированная или кипяченая вода.[1]
Постконтактная профилактика
После воздействия Б. pseudomallei (особенно после несчастного случая в лаборатории) рекомендуется лечение котримоксазолом. В качестве альтернативы, коамоксиклав и доксициклин можно применять тем, кто не переносит ко-тримоксазол. Поскольку котримоксазол может вызывать серьезные побочные эффекты, такое лечение, как правило, проходят только люди из группы высокого риска. Вместо этого люди с низким уровнем риска будут получать частое наблюдение.[1]
Вакцинация
Несколько вакцин-кандидатов были протестированы на животных моделях. Тем не менее, вакцины-кандидаты на людях не испытывались. Основными препятствиями для вакцин являются ограниченная эффективность на животных моделях, установление лучшего метода введения вакцины людям, а также логистические и финансовые проблемы при проведении испытаний на людях в эндемичных районах.[7]
Уход
Лечение мелиоидоза делится на два этапа: внутривенную интенсивную фазу и фазу ликвидации для предотвращения рецидива. Выбор антибиотиков зависит от восприимчивости бактерий к различным антибиотикам. Б. pesudomallei обычно чувствителен к цефтазидиму, меропенему, имипенему и коамоксиклаву. Эти препараты предназначены для уничтожения бактерий. Он также чувствителен к доиксциклину, хлорамфениколу и ко-тримоксазолу. Эти препараты предназначены для подавления роста бактерий. Бактерии устойчивы к пенициллину, ампициллину первого и второго поколения. цефалоспорин, гентамицин, стрептомицин, тобрамицин, макролиды и полимиксины.[1] Б. pseudomallei изолирует из области Саравак, Малайзия однако чувствительны к гентамицину.[1]
Интенсивная фаза
Внутривенно цефтазидим в настоящее время является препаратом выбора для лечения острого мелиоидоза и должен применяться в течение не менее 10 дней. Меропенем, имипенем, а цефоперазон -сульбактам комбинация (сульперазон) также эффективны.[1] Внутривенный амоксициллин-клавуланат (коамоксиклав) может использоваться, если ни один из четырех вышеупомянутых препаратов не доступен;[1] Коамоксиклав предотвращает смерть от мелиоидоза, как и цефтазидим.[5] Внутривенно антибиотики даются минимум на 10 дней. Среднее время купирования лихорадки при мелиоидозе составляет 9 дней.[1]
Меропенем является предпочтительным антибиотиком для лечения неврологического мелиоидоза и пациентов с септический шок допущен в отделения интенсивной терапии. Ко-тримоксазол рекомендуется при неврологическом мелиидозе, остеомиелите, септическом артрите, кожных и желудочно-кишечных инфекциях, а также при глубоко расположенных абсцессах. При глубоких инфекциях, таких как абсцессы внутренних органов, остеомиелит, септический артрит и неврологический мелиоидоз, продолжительность приема антибиотиков должна быть больше (до 4-8 недель). Время, необходимое для разрешения лихорадки, может составлять более 10 дней у людей с глубоко укоренившейся инфекцией. Устойчивость к цефтазидиму, карбапенемам и коамоксиклаву встречается редко в интенсивной фазе, но более заметна во время эрадикационной терапии. Никаких различий между использованием цефоперазона / сульбактама или цефтазидима для лечения мелиоидоза не наблюдается, так как оба показывают одинаковые показатели смертности и прогрессирования заболевания после лечения.[2] Для пациентов с почечной недостаточностью следует снизить дозировку цефтазидима, меропенема и ко-тримоксазола.[3] После улучшения клинического состояния меропенем можно снова заменить цефтазидимом.[1] Неясно, снижает ли комбинированная терапия цефтазидимом или меропенемом частоту рецидивов на ранней стадии лечения.[14]
Фаза искоренения
После лечения острого заболевания препаратом выбора является эрадикационная (или поддерживающая) терапия ко-тримоксазолом, которую следует использовать не менее 3 месяцев. Для людей с неврологическим мелиоидозом и остеомиелит, препараты следует давать более 6 месяцев. Коамоксиклав и доксициклин - препараты второго выбора. Ко-тримоксазол не следует применять пациентам с глюкозо-6-фосфатдегидрогеназа дефицит, так как он может вызвать гемолитическая анемия. Другие побочные эффекты, такие как сыпь, гиперкалиемия, нарушение функции почек и желудочно-кишечные симптомы должны побуждать к снижению доз ко-тримоксазола. Хлорамфеникол больше не рекомендуется для этой цели. Коамоксиклав является альтернативой для пациентов, которые не могут принимать котримоксазол и доксициклин (например, беременные женщины и дети в возрасте до 12 лет), но он не столь эффективен и имеет более высокую частоту рецидивов. Однокомпонентное лечение с фторхинолон (например., ципрофлоксацин ) или доксициклин для поддерживающей пероральной фазы неэффективны.[1]
В Австралии ко-тримоксазол применяют детям и беременным женщинам после первых 12 недель беременности. Между тем, в Таиланде коамоксиклав - препарат выбора для детей и беременных женщин. Тем не мение, Б. pseudomallei часто приобретает резистентность при применении коамоксиклава. Также сообщалось о случаях успешного лечения мелиоидоза котримоксазолом в течение 3 месяцев без прохождения интенсивной терапии при условии, что наблюдаются только кожные проявления без вовлечения внутренних органов или сепсиса.[1] Устойчивость к котримоксазолу в Австралии встречается редко.[2]
Хирургия
Хирургический дренаж показан при единичных больших абсцессах в печени, мышцах и простате. Однако при множественных абсцессах в печени, селезенке и почках хирургическое дренирование может оказаться невозможным или необходимым. При септическом артрите артротомия требуется смыв и дренаж. Хирургический обработка раны может быть необходимо. Для тех, у кого микотическая аневризма требуется срочная операция по протезированию сосудистых трансплантатов. Людям с протезами сосудистых трансплантатов может потребоваться пожизненная терапия котримоксазолом. Другие абсцессы необходимо дренировать редко, потому что большинство из них можно лечить антибиотиками.[1] В Австралии абсцесс простаты может потребовать стандартного визуализации и дренирования.[11]
Другие
Иммуномодулирующие методы лечения, такие как колониестимулирующий фактор гранулоцитов,[7] Интерлейкин 7, и анти-PDI (запрограммированная гибель клеток ) может быть полезным при лечении мелиоидоза, особенно при септическом шоке. Это потому, что эти препараты могут помочь повысить иммунную функцию человеческого организма против бактерий.[1]
Прогноз
В условиях хорошо обеспеченных ресурсами, где болезнь можно обнаружить и вылечить на ранней стадии, риск смерти составляет 10%. В условиях ограниченных ресурсов риск смерти от болезни составляет более 40%.[1]
Для пациентов с неполным лечением - повторное появление симптомов после периода болезни. ремиссия ("обострение ") может произойти. Затем для внутривенного введения антибиотиков необходима госпитализация. У тех, кто успешно завершил лечение, рецидив также может произойти из-за обострения или новой инфекции мелиоидоза. При более эффективных методах лечения частота рецидивов снизилась с 10 до 5%. Новая инфекция в настоящее время встречается чаще, чем рецидив. Факторы риска рецидива включают тяжесть заболевания (пациенты с положительным посевом крови или мультифокальным заболеванием имеют более высокий риск рецидива), выбор антибиотика для эрадикационной терапии (монотерапия доксициклином и терапия фторхинолоном не применяются как эффективный), плохое соблюдение режима эрадикационной терапии и продолжительность эрадикационной терапии менее 8 недель.[1]
Основные медицинские состояния, такие как сахарный диабет, хроническое заболевание почек и рак, могут ухудшить долгосрочную выживаемость и инвалидность тех, кто выздоравливает после инфекции. Наиболее серьезным осложнением мелиоидоза является: энцефаломиелит. Это может вызвать квадрипарез (мышечную слабость во всех конечностях), частичный вялый парапарез (мышечную слабость обеих ног) или провисание стопы. У пациентов с предшествующими инфекциями костей и суставов, ассоциированными с мелиоидозом, могут возникнуть такие осложнения, как: синус инфекция, деформации костей и суставов с ограниченным диапазоном движений.[1]
Эпидемиология

Мелиоидоз - малоизученное заболевание, которое остается эндемическим в развивающихся странах. В 2015 году было создано Международное общество мелиоидоза для повышения осведомленности об этой болезни.[1] В 2016 г. статистическая модель был разработан, который показал, что это число составляет 165 000 случаев в год, 138 000 из которых происходят в Восточной и Южной Азии и Тихоокеанском регионе.[15] Примерно в половине этих случаев (54% или 89 000) люди умрут.[1] Недостаточная отчетность является распространенной проблемой, поскольку с 2010 года во всем мире было зарегистрировано только 1300 случаев, что составляет менее 1% от прогнозируемой заболеваемости на основе моделирования.[1] Отсутствие лабораторных диагностических возможностей и недостаточная осведомленность медицинских работников о болезнях также являются причиной недиагностики. Даже если бактериальные культуры окажутся положительными на Б. pesudomallei, их можно выбросить как загрязнители, особенно в лабораториях в неэндемичных районах.[1] По состоянию на 2018 г. мелиоидоз не включен в список ВОЗ забытые тропические болезни.[1]
Мелиоидоз является эндемическим заболеванием в некоторых частях Юго-Восточной Азии (включая Таиланд,[16] Лаос,[17] Сингапур,[18] Бруней,[19] Малайзия,[20] Мьянма[21] и Вьетнам[22]), южный Китай,[23] Тайвань[24] и северная Австралия.[25] Сильные дожди могут увеличиться до центральной Австралии.[25] Индия,[26] и единичные случаи в Южной Америке.[27] Истинное бремя мелиоидоза в Африке и на Ближнем Востоке остается неизвестным из-за небольшого количества данных. Было предсказано, что 24 африканские страны и три страны Ближнего Востока будут эндемичными по мелиоидозу, однако ни одного случая из них не зарегистрировано.[28] В 1961–2017 гг. В Бангладеш был зарегистрирован 51 случай мелиоидоза. Тем не менее, недостаток осведомленности и ресурсов ведет к недиагностированию болезни в стране.[29] В Соединенных Штатах Америки было зарегистрировано два исторических случая (1950 и 1971) и три недавних случая (2010, 2011, 2013) среди людей, которые не выезжали за границу. Несмотря на обширные исследования, источник мелиоидоза так и не был подтвержден. Одно из возможных объяснений состоит в том, что импорт лекарственных растительных продуктов или экзотических рептилий мог привести к появлению мелиоидоза в Соединенных Штатах.[3] В Европе более половины случаев мелиоидоза завозятся из Таиланда.[30]
Мелиоидоз встречается во всех возрастных группах.[1] Для Австралии и Таиланда средний возраст инфицирования составляет 50 лет; От 5 до 10% пациентов моложе 15 лет.[1] Единственным наиболее важным фактором риска развития мелиоидоза является сахарный диабет, за которым следует опасное употребление алкоголя, хроническое заболевание почек и хроническое заболевание легких.[31] Более 50% людей с мелиоидозом страдают диабетом; у диабетиков риск заболевания мелиоидозом увеличивается в 12 раз. Диабет снижает способность макрофагов бороться с бактериями и снижает Т-хелперная клетка производство. Чрезмерное высвобождение фактор некроза опухоли альфа и интерлейкин 12 к мононуклеарные клетки увеличивает риск септического шока. Лекарство от диабета глибенкламид может также притупить воспалительные реакции моноцитов.[1] Другие факторы риска включают: талассемия, профессиональное облучение (например, рисовые поля фермеры),[7] контакт с почвой, водой в рекреационных целях, мужской возраст старше 45 лет и длительное употребление стероидов / иммуносупрессия,[1] но 8% детей и 20% взрослых больных мелиоидозом не имеют факторов риска.[1] ВИЧ инфекция не предрасполагает к мелиоидозу.[7] Младенец сообщалось о случаях, возможно, из-за передачи от матери ребенку, внебольничной инфекции или инфекции, связанной с оказанием медицинской помощи.[1] Те, кто здоров, также могут быть заражены Б. pseudomallei. Например, 25% детей, проживающих в эндемичный areas started producing antibodies против Б. pseudomallei between 6 months and 4 years old, suggesting they were exposed to it over this time. This means that many people without symptoms will test positive in serology tests in endemic areas.[2] In Thailand, the seropositivity rate exceeds 50%, while in Australia, the seropositivity rate is only 5%.[3] The disease is clearly associated with increased rainfall, with the number of cases rising following increased precipitation. Severe rainfall increases the concentration of the bacteria in the topsoil, thus increasing the risk of transmitting the bacteria through the air.[7]
История
Патолог Alfred Whitmore and his assistant Krishnaswami first reported melioidosis among beggars and morphine addicts at autopsy in Rangoon, present-day Мьянма, in a report published in 1912.[4] Артур Конан Дойл may have read the 1912 report before writing a short story that involved the fictitious tropical disease "Tapanuli fever" in a Шерлок Холмс приключение.[32] In the 1913 story of “Умирающий детектив ”, Holmes received a box designed to inoculate the victim with “Tapanuli fever” upon opening. “Tapanuli fever” was thought by many to represent melioidosis.[11] The term “melioidosis” was first coined in 1921.[1] It was distinguished from glanders, a disease of humans and animals that is similar in presentation, but caused by a different micro-organism. Б. pseudomallei, also known as the Whitmore bacillus, was identified in 1917 in Куала Лумпур.[33] The first human case of melioidosis was reported in Sri Lanka in 1927.[1] In 1932, 83 cases were reported in South and Southeast Asia with 98% mortality.[1] In 1936, the first animal (sheep) case of melioidosis was reported in Madagascar, South Africa.[1] In 1937, soil and water were identified as the habitats of Б. pseudomallei.[1] Вовремя война во Вьетнаме from 1967 to 1973, 343 American soldiers were reported with melioidosis, with about 50 cases transmitted through inhalation.[1] An outbreak of melioidosis at the Paris Zoo in the 1970s (known as L’affaire du jardin des plantes) was thought to have originated from an imported панда or horses from Iran.[11][34] The first evidence of Б. pseudomallei (in soil) in Brazil was reported in 1983.[1]
Prior to 1989, the standard treatment for acute melioidosis was a three-drug combination of chloramphenicol, co-trimoxazole, and doxycycline; this regimen is associated with a mortality rate of 80% and is no longer used unless no other alternatives are available.[35] All three drugs are bacteriostatic (they stop the bacterium from growing, but do not kill it) and the action of co-trimoxazole antagonizes both chloramphenicol and doxycycline.[36] Aerosolised Б. pseudomallei was first isolated in 1989.[1] В том же году, ceftazidime had been shown to reduce the risk of death of melioidosis from 74% to 37%.[1] Б. pseudomallei was previously classified as part of the genus Псевдомонады до 1992 г.[37] In 1992, the pathogen was formally named Б. pseudomallei.[1] The name melioidosis is derived from the Greek melis (μηλις) meaning "a distemper of asses" with the suffixes -oid meaning "similar to" and -osis meaning "a condition", that is, a condition similar to glanders.[37] В 2002, Б. pseudomallei was classified as a "category B agent". Живой attenuated vaccine was developed in mice in the same year. В 2003 г. мультилокусная последовательность за Б. pseudomallei был развит. В 2012, B pseudomallei was classified as a "tier-1 select agent" by the U.S. Centers for Disease Control. In 2014, co-trimoxazole was established as the oral eradication therapy. В 2015 г. Б. pseudomallei DNA was detected in filtered air using quantitative PCR.[1] In 2016, a statistical model was developed to predict the occurrence of global melioidosis per year. В 2017 г. секвенирование всего генома suggested Australia as the early reservoir for melioidosis.[1]
Синонимы
- Pseudoglanders[38]
- Whitmore's disease (after Captain Alfred Whitmore, who first described the disease)[4]
- Nightcliff gardener's disease (Nightcliff это пригород Дарвин, Австралия where melioidosis is endemic)[39]
- Paddy-field disease[40]
- Morphia injector's septicaemia[41]
Биологическая война
Interest in melioidosis has been expressed because it has the potential to be developed as a биологическое оружие. Another similar bacterium, B. mallei, was used by the Germans in Первая Мировая Война to infect livestock shipped to Allied countries.[42] Deliberate infection of human военнопленные and animals using B. mallei were carried out in China's Пинфан район by the Japanese during World War II.[11] В Советский союз reportedly used B. mallei вовремя Советско-афганская война in 1982 and 1984.[42] Б. pseudomallei, подобно B. mallei, was studied by both the US[43] and Soviet Union as a potential biological warfare agent, but never weaponized.[42] Other countries such as Iran, Iraq, North Korea, and Syria may have investigated the properties of Б. pseudomallei for biological weapons. The bacterium is readily available in the environment and is cost-effective to produce. It can also be aerosolized and transmitted via inhalation. Тем не менее Б. pseudomallei has never been used in biological warfare.[2]
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве в au средний ау топор ай az ба bb до н.э bd быть парень bg бх би Ъ bk бл бм млрд бо бп бк br bs bt бу bv чб bx к bz ок cb cc CD ce ср cg ch ci cj ск cl см сп co cp cq cr cs ct Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DA, Limmathurotsakul D (February 2018). "Melioidosis". Обзоры природы. Праймеры для болезней. 4 (17107): 17107. Дои:10.1038/nrdp.2017.107. ЧВК 6456913. PMID 29388572.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Foong YC, Tan M, Bradbury RS (30 October 2014). "Melioidosis: a review". Rural and Remote Health. 14 (4): 2763. PMID 25359677.
- ^ а б c d е ж грамм час я j k л м п о п q Currie BJ (February 2015). "Melioidosis: evolving concepts in epidemiology, pathogenesis, and treatment". Seminars in Respiratory and Critical Care Medicine. 36 (1): 111–25. Дои:10.1055/s-0034-1398389. PMID 25643275.
- ^ а б c Whitmore A, Krishnaswami CS (1912). "An account of the discovery of a hitherto undescribed infectious disease among the population of Rangoon". Индийский медицинский вестник. 47: 262–267.
- ^ а б c Bennett JE, Raphael D, Martin JB, Currie BJ (2015). "223". Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета (Восьмое изд.). Эльзевир. pp. 2541–2549. ISBN 978-1-4557-4801-3.
- ^ Fertitta L, Monsel G, Torresi J, Caumes E (February 2019). "Cutaneous melioidosis: a review of the literature". Международный журнал дерматологии. 58 (2): 221–227. Дои:10.1111/ijd.14167. PMID 30132827.
- ^ а б c d е ж грамм час я j k л м п о п q р Gassiep I, Armstrong M, Norton R (March 2020). "Human Melioidosis". Обзоры клинической микробиологии. 33 (2). Дои:10.1128/CMR.00006-19. ЧВК 7067580. PMID 32161067.
- ^ а б Ngauy V, Lemeshev Y, Sadkowski L, Crawford G (February 2005). "Cutaneous melioidosis in a man who was taken as a prisoner of war by the Japanese during World War II". Журнал клинической микробиологии. 43 (2): 970–2. Дои:10.1128/JCM.43.2.970-972.2005. ЧВК 548040. PMID 15695721.
- ^ Gee JE, Gulvik CA, Elrod MG, Batra D, Rowe LA, Sheth M, Hoffmaster AR (July 2017). "Phylogeography of Burkholderia pseudomallei Isolates, Western Hemisphere". Возникающие инфекционные заболевания. 23 (7): 1133–1138. Дои:10.3201/eid2307.161978. ЧВК 5512505. PMID 28628442.
- ^ Chodimella U, Hoppes WL, Whalen S, Ognibene AJ, Rutecki GW (May 1997). "Septicemia and suppuration in a Vietnam veteran". Hospital Practice. 32 (5): 219–21. Дои:10.1080/21548331.1997.11443493. PMID 9153149.
- ^ а б c d е ж грамм Cheng AC, Currie BJ (April 2005). "Melioidosis: epidemiology, pathophysiology, and management". Обзоры клинической микробиологии. 18 (2): 383–416. Дои:10.1128/CMR.18.2.383-416.2005. ЧВК 1082802. PMID 15831829.
- ^ Baker A, Pearson T, Price EP, Dale J, Keim P, Hornstra H, et al. (Март 2011 г.). "Molecular phylogeny of Burkholderia pseudomallei from a remote region of Papua New Guinea". PLOS ONE. 6 (3): e18343. Bibcode:2011PLoSO...618343B. Дои:10.1371/journal.pone.0018343. ЧВК 3069084. PMID 21483841.

- ^ Centers for Disease Control and Prevention (2009). Biosafety in Microbiological and Biomedical Laboratories (5-е изд.). Atlanta, Georgia: National Institutes of Health.
- ^ Samuel M, Ti TY, et al. (Cochrane Infectious Diseases Group) (2002-10-21). "Interventions for treating melioidosis". Кокрановская база данных систематических обзоров (4): CD001263. Дои:10.1002/14651858.CD001263. ЧВК 6532693. PMID 12519552.
- ^ Limmathurotsakul D, Golding N, Dance DA, Messina JP, Pigott DM, Moyes CL, et al. (January 2016). "Burkholderia pseudomallei and burden of melioidosis". Природная микробиология. 1 (1): 15008. Дои:10.1038/nmicrobiol.2015.8. ЧВК 4746747. PMID 26877885.
- ^ Hinjoy S, Hantrakun V, Kongyu S, Kaewrakmuk J, Wangrangsimakul T, Jitsuronk S, et al. (8 April 2018). "Melioidosis in Thailand: Present and Future". Tropical Medicine and Infectious Disease. 3 (2): 38. Дои:10.3390/tropicalmed3020038. ЧВК 5928800. PMID 29725623.
- ^ Dance DA, Luangraj M, Rattanavong S, Sithivong N, Vongnalaysane O, Vongsouvath M, Newton PN (February 2018). "Melioidosis in the Lao People's Democratic Republic". Tropical Medicine and Infectious Disease. 3 (1): 21. Дои:10.3390/tropicalmed3010021. ЧВК 6136615. PMID 30274419.
- ^ Sim SH, Ong CE, Gan YH, Wang D, Koh VW, Tan YK, et al. (Март 2018 г.). "Melioidosis in Singapore: Clinical, Veterinary, and Environmental Perspectives". Tropical Medicine and Infectious Disease. 3 (1): 31. Дои:10.3390/tropicalmed3010031. ЧВК 6136607. PMID 30274428.
- ^ Pande K, Abd Kadir KA, Asli R, Chong VH (February 2018). "Melioidosis in Brunei Darussalam". Tropical Medicine and Infectious Disease. 3 (1): 20. Дои:10.3390/tropicalmed3010020. ЧВК 6136610. PMID 30274418.
- ^ Nathan S, Chieng S, Kingsley PV, Mohan A, Podin Y, Ooi MH, et al. (Февраль 2018). "Melioidosis in Malaysia: Incidence, Clinical Challenges, and Advances in Understanding Pathogenesis". Tropical Medicine and Infectious Disease. 3 (1): 25. Дои:10.3390/tropicalmed3010025. ЧВК 6136604. PMID 30274422.
- ^ Win MM, Ashley EA, Zin KN, Aung MT, Swe MM, Ling CL, et al. (Март 2018 г.). "Melioidosis in Myanmar". Tropical Medicine and Infectious Disease. 3 (1): 28. Дои:10.3390/tropicalmed3010028. ЧВК 6136617. PMID 30274425.
- ^ Trinh TT, Nguyen LD, Nguyen TV, Tran CX, Le AV, Nguyen HV, et al. (Апрель 2018 г.). "Melioidosis in Vietnam: Recently Improved Recognition but still an Uncertain Disease Burden after Almost a Century of Reporting". Tropical Medicine and Infectious Disease. 3 (2): 39. Дои:10.3390/tropicalmed3020039. ЧВК 6073866. PMID 30274435.
- ^ Zheng X, Xia Q, Xia L, Li W (February 2019). "Endemic Melioidosis in Southern China: Past and Present". Tropical Medicine and Infectious Disease. 4 (1): 39. Дои:10.3390/tropicalmed4010039. ЧВК 6473618. PMID 30823573.
- ^ Hsueh PT, Huang WT, Hsueh HK, Chen YL, Chen YS (February 2018). "Transmission Modes of Melioidosis in Taiwan". Tropical Medicine and Infectious Disease. 3 (1): 26. Дои:10.3390/tropicalmed3010026. ЧВК 6136622. PMID 30274423.
- ^ а б Smith S, Hanson J, Currie BJ (March 2018). "Melioidosis: An Australian Perspective". Tropical Medicine and Infectious Disease. 3 (1): 27. Дои:10.3390/tropicalmed3010027. ЧВК 6136632. PMID 30274424.
- ^ Mukhopadhyay C, Shaw T, Varghese GM, Dance DA (May 2018). "Melioidosis in South Asia (India, Nepal, Pakistan, Bhutan and Afghanistan)". Tropical Medicine and Infectious Disease. 3 (2): 51. Дои:10.3390/tropicalmed3020051. ЧВК 6073985. PMID 30274447.
- ^ Rolim DB, Lima RX, Ribeiro AK, Colares RM, Lima LD, Rodríguez-Morales AJ, et al. (Июнь 2018). "Melioidosis in South America". Tropical Medicine and Infectious Disease. 3 (2): 60. Дои:10.3390/tropicalmed3020060. ЧВК 6073846. PMID 30274456.
- ^ Steinmetz I, Wagner GE, Kanyala E, Sawadogo M, Soumeya H, Teferi M, et al. (Июнь 2018). "Melioidosis in Africa: Time to Uncover the True Disease Load". Tropical Medicine and Infectious Disease. 3 (2): 62. Дои:10.3390/tropicalmed3020062. ЧВК 6073667. PMID 30274458.
- ^ Chowdhury FR, Jilani MS, Barai L, Rahman T, Saha MR, Amin MR, et al. (Апрель 2018 г.). "Melioidosis in Bangladesh: A Clinical and Epidemiological Analysis of Culture-Confirmed Cases". Tropical Medicine and Infectious Disease. 3 (2): 40. Дои:10.3390/tropicalmed3020040. ЧВК 6073520. PMID 30274436.
- ^ Le Tohic S, Montana M, Koch L, Curti C, Vanelle P (August 2019). "A review of melioidosis cases imported into Europe". Европейский журнал клинической микробиологии и инфекционных заболеваний. 38 (8): 1395–1408. Дои:10.1007/s10096-019-03548-5. PMID 30949898.
- ^ Suputtamongkol Y, Chaowagul W, Chetchotisakd P, Lertpatanasuwun N, Intaranongpai S, Ruchutrakool T, et al. (Август 1999 г.). "Risk factors for melioidosis and bacteremic melioidosis". Клинические инфекционные болезни. 29 (2): 408–13. Дои:10.1086/520223. PMID 10476750.
- ^ Vora SK (February 2002). "Sherlock Holmes and a biological weapon". Журнал Королевского медицинского общества. 95 (2): 101–3. Дои:10.1258/jrsm.95.2.101. ЧВК 1279324. PMID 11823558.
- ^ Strong RP (1944). Stitt's Diagnosis, Prevention and Treatment of Tropical Diseases (7-е изд.). Philadelphia: The Blakiston Company. п. 732.
- ^ Mollaret HH (1988). ""L'affaire du Jardin des plantes" ou comment le mélioïdose fit son apparition en France". Médecine et Maladies Infectieuses. 18 (Suppl 4): 643–654. Дои:10.1016/S0399-077X(88)80175-6.
- ^ White NJ, Dance DA, Chaowagul W, Wattanagoon Y, Wuthiekanun V, Pitakwatchara N (September 1989). "Halving of mortality of severe melioidosis by ceftazidime". Ланцет. 2 (8665): 697–701. Дои:10.1016/S0140-6736(89)90768-X. PMID 2570956.
- ^ Dance DA, Wuthiekanun V, Chaowagul W, White NJ (September 1989). "Interactions in vitro between agents used to treat melioidosis". Журнал антимикробной химиотерапии. 24 (3): 311–6. Дои:10.1093/jac/24.3.311. PMID 2681117.
- ^ а б Stanton AT, Fletcher W (1921). "Melioidosis, a new disease of the tropics". Far Eastern Association of Tropical Medicine: Transactions of the Fourth Congress. Batavia, Dutch East Indies: Javasche Boekhandel en Drukkerij.
- ^ Chai LY, Fisher D (August 2018). "Earth, wind, rain, and melioidosis". Ланцет. Planetary Health. 2 (8): e329–e330. Дои:10.1016/S2542-5196(18)30165-7. PMID 30082045.
- ^ Barker A (19 June 2005). "Rise in melioidosis rates in NT". Австралийская радиовещательная корпорация. Получено 2007-06-24.
- ^ Orellana C (November 2004). "Melioidosis strikes Singapore". Ланцет. Инфекционные заболевания. 4 (11): 655. Дои:10.1016/S1473-3099(04)01190-9. PMID 15534940.
- ^ Krishnaswami CS. "Morphia injectors' septicaemia". Индийский медицинский вестник. 52 (1917): 296–299.
- ^ а б c Nguyen HV, Smith ME, Hayoun MA (27 October 2018). "Glanders and Melioidosis". StatPearls. StatPearls Publishing. PMID 28846298. NBK448110.
- ^ Withers MR, ed. (2014). Руководство USAMRIID по медицинскому ведению биологических травм (PDF) (8-е изд.). Форт Детрик, Мэриленд: Медицинский институт инфекционных болезней армии США. п. 53.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
- Burkholderia pseudomallei геномы и связанную информацию на ПАТРИК Ресурсный центр по биоинформатике, финансируемый НИАИД
- Monograph on Melioidosis (ISBN 978-0-444-53479-8); Elsevier Press, 2012, https://espaces.edu.au/melioidosis/melioidosis-a-century-of-observation-and-research
