Калиевый канал внутрь выпрямителя - Inward-rectifier potassium channel
| Калиевый канал внутреннего выпрямителя | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура калиевого канала внутреннего выпрямителя | |||||||||
| Идентификаторы | |||||||||
| Символ | IRK | ||||||||
| Pfam | PF01007 | ||||||||
| Pfam клан | CL0030 | ||||||||
| ИнтерПро | IPR013521 | ||||||||
| SCOP2 | 1н9п / Объем / СУПФАМ | ||||||||
| TCDB | 1.A.2 | ||||||||
| OPM суперсемейство | 8 | ||||||||
| Белок OPM | 3 САУ | ||||||||
| |||||||||
Калиевые каналы внутреннего выпрямителя (Kir, IRK) являются специфическим липид-зависимый подмножество калиевые каналы. На сегодняшний день идентифицировано семь подсемейств в различных типах клеток млекопитающих,[1] растения[2] и бактерии.[3] Они активируются фосфатидилинозитол-4,5-бисфосфатом (PIP2 ). Неисправность каналов связана с несколькими заболеваниями.[4][5] Каналы IRK имеют поровый домен, гомологичный таковому потенциалзависимые ионные каналы, и фланговые трансмембранные сегменты (ТМС). Они могут существовать в мембране в виде гомо- или гетероолигомеров, и каждый мономер содержит от 2 до 4 ТМС. С точки зрения функции эти белки транспортируют калий (К+), с большей тенденцией для K+ поглощение, чем K+ экспорт.[3] Процесс внутреннего исправления был открыт Денис Ноубл в клетках сердечной мышцы в 1960-х гг. Ричард Адриан и Алан Ходжкин в 1970 г. в клетках скелетных мышц.[6]
Обзор внутреннего ректификации
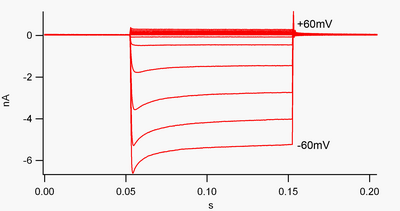
Канал, который «выпрямляется вовнутрь», - это канал, по которому ток (положительный заряд) легче проходит во внутреннем направлении (в ячейку), чем в наружном направлении (из ячейки). Считается, что этот ток может играть важную роль в регулировании активности нейронов, помогая стабилизировать мембранный потенциал покоя ячейки.
По соглашению, входящий ток (положительный заряд, движущийся в ячейку) отображается в зажим напряжения как отклонение вниз, в то время как наружный ток (положительный заряд, выходящий из ячейки) показан как отклонение вверх. При отрицательных мембранных потенциалах по отношению к калию обратный потенциал, выпрямляя внутрь K+ каналы поддерживают поток положительно заряженных K+ ионы в клетку, подталкивая мембранный потенциал обратно к потенциалу покоя. Это можно увидеть на рисунке 1: когда мембранный потенциал ограничивается отрицательным значением потенциала покоя канала (например, -60 мВ), течет внутренний ток (т.е. положительный заряд течет в ячейку). Однако, когда мембранный потенциал установлен положительным по отношению к потенциалу покоя канала (например, +60 мВ), эти каналы пропускают очень небольшой ток. Проще говоря, этот канал пропускает намного больше тока во внутрь, чем наружу, в своем рабочем диапазоне напряжений. Эти каналы не являются идеальными выпрямителями, так как они могут пропускать некоторый внешний ток в диапазоне напряжений примерно на 30 мВ выше потенциала покоя.
Эти каналы отличаются от калиевых каналов, которые обычно отвечают за реполяризацию клетки после потенциал действия, такой как выпрямитель с задержкой и Тип калиевые каналы. Эти более «типичные» калиевые каналы преимущественно проводят наружу (а не внутрь) калиевые токи при деполяризованных мембранных потенциалах, и их можно рассматривать как «внешнее выпрямление». Когда впервые было обнаружено, что внутреннее выпрямление было названо «аномальным выпрямлением», чтобы отличить его от выходящих наружу калиевых токов.[7]
Внутренние выпрямители также отличаются от тандемные поровые доменные калиевые каналы, которые во многом ответственны за «утечку» K+ токи.[8] Некоторые внутренние выпрямители, называемые «слабые внутренние выпрямители», имеют измеряемый внешний K+ токи при напряжениях положительных к K+ реверсивный потенциал (соответствующий, но больший, чем небольшие токи над линией 0 нА на рисунке 1). Они вместе с каналами «утечки» устанавливают мембранный потенциал покоя клетки. Другие каналы внутреннего выпрямления, называемые «сильными внутренними выпрямителями», вообще несут очень небольшой внешний ток и в основном активны при напряжениях, отрицательных по отношению к K+ обратный потенциал, когда они несут входящий ток (гораздо большие токи ниже линии 0 нА на рисунке 1).[9]
Механизм внутреннего выпрямления
Явление внутреннего выпрямления Kir каналов является результатом высокоаффинного блокирования эндогенными полиамины, а именно спермин, а также магний ионы, которые затыкают канал поры при положительных потенциалах, что приводит к уменьшению выходных токов. Этот зависящий от напряжения блок полиаминов приводит к эффективной проводимости тока только во внутреннем направлении. Хотя основная идея полиаминового блока понятна, конкретные механизмы все еще остаются спорными.[10]
Активация PIP2
Все Kir каналы требуют фосфатидилинозитол-4,5-бисфосфат (PIP2) для активации.[11] PIP2 связывает и напрямую активирует Kir 2.2 с агонистическими свойствами.[12] В связи с этим Kir каналы - PIP2 ионные каналы, управляемые лигандами.
Роль Кir каналы
Kir каналы находятся в нескольких типах ячеек, включая макрофаги, сердечный и почка клетки лейкоциты, нейроны, и эндотелиальные клетки. Посредством небольшого деполяризующий K+ тока при отрицательном мембранном потенциале они помогают установить мембранный потенциал покоя, а в случае Kir3 группы, они помогают опосредовать тормозящие нейротрансмиттер ответы, но их роль в клеточной физиологии различается в зависимости от типа клеток:
| Место расположения | Функция |
|---|---|
| сердечные миоциты | Kir каналы закрываются при деполяризации, замедляя реполяризацию мембраны и помогая поддерживать более длительное потенциал сердечного действия. Этот тип канала внутреннего выпрямителя отличается от выпрямитель с задержкой К+ каналы, которые помогают реполяризовать нервные и мышечные клетки после потенциалы действия; и каналы утечки калия, которые во многом составляют основу мембранный потенциал покоя. |
| эндотелиальные клетки | Kir каналы участвуют в регулировании синтаза оксида азота. |
| почки | Kir экспортировать излишки калия в собирательные канальцы для удаления с мочой или, альтернативно, может участвовать в обратном захвате калия обратно в организм. |
| нейроны и в клетках сердца | Активированные G-белком IRK (Kir3) являются важными регуляторами, регулируемыми нейротрансмиттерами. Мутация в GIRK2 канал приводит к мутации мыши-ткача. Мутантные мыши "Weaver" атаксичны и демонстрируют опосредованную нейровоспалением дегенерацию их дофаминергических нейронов.[13] По сравнению с неатаксическим контролем, у мутантов Уивера наблюдается дефицит моторной координации и изменения в региональном метаболизме мозга.[14] Мыши Weaver были исследованы в лабораториях, заинтересованных в развитии нервной системы и заболеваниях более 30 лет. |
| панкреатический бета-клетки | KАТФ каналы (состоит из Kir6.2 и SUR1 субъединицы) контролируют высвобождение инсулина. |
Регулирование
Зависимость от напряжения может регулироваться внешним K+, внутренним Mg2+, внутренними АТФ и / или G-белки. P-домены IRK-каналов демонстрируют ограниченное сходство последовательностей с таковыми из семейства VIC. Внутренние выпрямители играют роль в установке потенциалов клеточной мембраны, и закрытие этих каналов при деполяризации позволяет возникать длительные потенциалы действия с фазой плато. У внутренних выпрямителей отсутствуют внутренние спирали измерения напряжения, которые можно найти во многих каналах семейства VIC. В некоторых случаях, например, Kir1.1a, Kir6.1 и Kir6.2, было предложено прямое взаимодействие с членом суперсемейства ABC для придания уникальных функциональных и регуляторных свойств гетеромерному комплексу, включая чувствительность к АТФ. . Эти АТФ-чувствительные каналы находятся во многих тканях организма. Они делают активность канала зависимой от цитоплазматического соотношения АТФ / АДФ (увеличение АТФ / АДФ закрывает канал). Человеческие SUR1 и SUR2 сульфонилмочевина рецепторы (spQ09428 и Q15527 соответственно) представляют собой белки ABC, которые регулируют каналы Kir6.1 и Kir6.2 в ответ на АТФ и CFTR (ТК № 3.A.1.208.4 ) может регулировать Kir1.1a.[15]
Структура
Кристаллическая структура[16] и функция[17] бактериальных членов семейства IRK-C. KirBac1.1, из Burkholderia pseudomallei, имеет длину 333 аминоацильных остатка (aas) с двумя N-концевыми TMS, фланкирующими P-петлю (остатки 1-150), а C-концевая половина белка является гидрофильной. Он переносит одновалентные катионы с селективностью: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM (протонированный N-метил-D-глюкамин ). Активность подавляется Ba2+, Ca2+и низкий pH.[17]
Классификация Kir каналы
Всего существует семь подсемейств Kir каналы, обозначенные как Kir1 - Кir7.[1] Каждое подсемейство состоит из нескольких членов (т. Е. Kir2.1, Кir2.2, Кir2.3 и т. Д.), Которые имеют почти идентичные аминокислотные последовательности у известных видов млекопитающих.
Kir каналы образуются из гомотетрамерных мембранных белков. Каждая из четырех идентичных белковых субъединиц состоит из двух пронизывающих мембрану альфа спирали (M1 и M2). Гетеротетрамеры могут образовываться между членами одного и того же подсемейства (например, Kir2.1 и Kir2.3), когда каналы сверхэкспрессированы.
Разнообразие
| Ген | Протеин | Псевдонимы | Ассоциированные субъединицы |
|---|---|---|---|
| KCNJ1 | Kir1.1 | ROMK1 | NHERF2 |
| KCNJ2 | Kir2.1 | IRK1 | Kir2.2, Кir4.1, PSD-95, SAP97, AKAP79 |
| KCNJ12 | Kir2.2 | IRK2 | Kir2.1 и Kir2.3 с образованием гетеромерного канала, вспомогательная субъединица: SAP97, Вели-1, Вели-3, ПСД-95 |
| KCNJ4 | Kir2.3 | IRK3 | Kir2.1 и Kir2.3 для формирования гетеромерного канала, PSD-95, Чапсын-110 / PSD-93 |
| KCNJ14 | Kir2.4 | IRK4 | Kir2.1 для образования гетеромерного канала |
| KCNJ3 | Kir3.1 | ГИРК1, КГА | Kir3.2, Кir3.4, Кir3,5, Кir3.1 не работает сам по себе |
| KCNJ6 | Kir3.2 | GIRK2 | Kir3.1, Кir3.3, Кir3.4 для образования гетеромерного канала |
| KCNJ9 | Kir3.3 | GIRK3 | Kir3.1, Кir3.2 для образования гетеромерного канала |
| KCNJ5 | Kir3.4 | GIRK4 | Kir3.1, Кir3.2, Кir3.3 |
| KCNJ10 | Kir4.1 | Kir1.2 | Kir4,2, Кir5.1, а Kir2.1 для образования гетеромерных каналов |
| KCNJ15 | Kir4.2 | Kir1.3 | |
| KCNJ16 | Kir5.1 | BIR 9 | |
| KCNJ8 | Kir6.1 | KАТФ | SUR2B |
| KCNJ11 | Kir6.2 | KАТФ | SUR1, SUR2A, и SUR2B |
| KCNJ13 | Kir7.1 | Kir1.4 |
- Стойкая гиперинсулинемическая гипогликемия младенческого возраста связана с аутосомно-рецессивными мутациями в Kir6.2. Определенные мутации этого гена снижают способность канала регулировать секрецию инсулина, что приводит к гипогликемия.
- Синдром Барттера могут быть вызваны мутациями в Kir каналы. Это состояние характеризуется неспособностью почек перерабатывать калий, вызывая низкий уровень калия в организме.
- Синдром Андерсена это редкое заболевание, вызванное множественными мутациями Kir2.1. В зависимости от мутации она может быть доминантной или рецессивной. Он характеризуется периодический паралич, сердечные аритмии и дисморфический Особенности. (Смотрите также KCNJ2 )
- Отравление барием вероятно из-за его способности блокировать Kir каналы.
- Атеросклероз (сердечное заболевание) может быть связано с Kir каналы. Потеря Kir токи в эндотелиальных клетках - один из первых известных индикаторов атерогенеза (начало болезни сердца).
- Тиреотоксический гипокалиемический периодический паралич был связан с измененным Kir2.6 функция.[18]
- Синдром ВОСТОК / СЕЗАМЕ может быть вызвано мутациями KCNJ10.[нужна цитата ]
Смотрите также
Рекомендации
- ^ а б Кубо Ю., Адельман Дж. П., Клэпхэм Д. Е., Ян Л. Ю., Каршин А., Курачи Ю., Лаздунски М., Николс CG, Seino S, Vandenberg CA (декабрь 2005 г.). "Международный союз фармакологии. LIV. Номенклатура и молекулярные отношения внутренне выпрямляющих калиевых каналов". Фармакологические обзоры. 57 (4): 509–26. Дои:10.1124 / пр.57.4.11. PMID 16382105.
- ^ Хедрих Р., Моран О., Конти Ф, Буш Х, Беккер Д., Гамбале Ф, Драйер И., Кюх А., Нойвингер К., Пальме К. (1995). «Калиевые каналы внутреннего выпрямителя в растениях отличаются от своих аналогов у животных в ответ на модуляторы напряжения и каналов». Европейский биофизический журнал. 24 (2): 107–15. Дои:10.1007 / BF00211406. PMID 8582318.
- ^ а б "1.A.2 Семейство каналов K с внутренним выпрямителем (IRK-C)". TCDB. Получено 2016-04-09.
- ^ Хансен, С.Б. (май 2015 г.). «Липидный агонизм: парадигма PIP2 лиганд-управляемых ионных каналов». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (5): 620–8. Дои:10.1016 / j.bbalip.2015.01.011. ЧВК 4540326. PMID 25633344.
- ^ Абрахам М.Р., Джахангир А., Алексеев А.Е., Терзич А. (ноябрь 1999 г.). «Каннелопатии внутренне выпрямляющих калиевых каналов». Журнал FASEB. 13 (14): 1901–10. Дои:10.1096 / fasebj.13.14.1901. PMID 10544173.
- ^ Адриан Р. Х., Чендлер В. К., Ходжкин А. Л. (июль 1970 г.). «Медленное изменение проницаемости калия в скелетных мышцах». Журнал физиологии. 208 (3): 645–68. Дои:10.1113 / jphysiol.1970.sp009140. ЧВК 1348790. PMID 5499788.
- ^ Бертил Хилле (2001). Ионные каналы возбудимых мембран. 3-е изд. (Синауэр: Сандерленд, Массачусетс), стр. 151. ISBN 0-87893-321-2.
- ^ Хилле, стр. 155.
- ^ Хилле, стр. 153.
- ^ Лопатин А.Н., Махина Е.Н., Николс К.Г. (ноябрь 1995 г.). «Механизм ректификации внутрь калиевых каналов:« закупорка длинных пор »цитоплазматическими полиаминами». Журнал общей физиологии. 106 (5): 923–55. Дои:10.1085 / jgp.106.5.923. ЧВК 2229292. PMID 8648298.
- ^ Такер SJ, Baukrowitz T (май 2008 г.). «Как сильно заряженные анионные липиды связывают и регулируют ионные каналы». Журнал общей физиологии. 131 (5): 431–8. Дои:10.1085 / jgp.200709936. ЧВК 2346576. PMID 18411329.
- ^ Хансен С.Б., Тао X, Маккиннон Р. (сентябрь 2011 г.). «Структурная основа активации PIP2 классического входящего выпрямителя K + канал Kir2.2». Природа. 477 (7365): 495–8. Bibcode:2011Натура.477..495H. Дои:10.1038 / природа10370. ЧВК 3324908. PMID 21874019.
- ^ Пэн Дж., Се Л., Стивенсон Ф. Ф., Мелов С., Ди Монте Д. А., Андерсен Дж. К. (ноябрь 2006 г.). «Нигростриатальная дофаминергическая нейродегенерация у мышей-ткачей опосредуется нейровоспалением и облегчается введением миноциклина». Журнал неврологии. 26 (45): 11644–51. Дои:10.1523 / JNEUROSCI.3447-06.2006. ЧВК 6674792. PMID 17093086.
- ^ Strazielle C, Deiss V, Naudon L, Raisman-Vozari R, Lalonde R (октябрь 2006 г.). «Региональные мозговые вариации активности цитохромоксидазы и моторной координации у мутантных мышей Girk2 (Wv) (Weaver)». Неврология. 142 (2): 437–49. Дои:10.1016 / j.neuroscience.2006.06.011. PMID 16844307.
- ^ Заявка WO 0190360, Wei MH, Chaturvedi K, Guegler K, Webster M, Ketchum KA, Di Francesco V, Beasley E, «Изолированные человеческие белки-переносчики, молекулы нуклеиновых кислот, кодирующие белки-переносчики человека, и их использование», опубликовано 29 ноября 2001 г., переуступлено Apperla Корпорация
- ^ Куо А., Гулбис Дж. М., Антклифф Дж. Ф., Рахман Т., Лоу Э.Д., Циммер Дж., Катбертсон Дж., Эшкрофт Ф.М., Эзаки Т., Дойл Д.А. (июнь 2003 г.). «Кристаллическая структура калиевого канала KirBac1.1 в закрытом состоянии». Наука. 300 (5627): 1922–6. Bibcode:2003Наука ... 300.1922K. Дои:10.1126 / science.1085028. PMID 12738871.
- ^ а б Энкветчакул Д., Бхаттачарья Дж., Джелиазкова И., Гросбек Д.К., Кукрас Калифорния, Николс К.Г. (ноябрь 2004 г.). «Функциональная характеристика прокариотического канала Кир». Журнал биологической химии. 279 (45): 47076–80. Дои:10.1074 / jbc.C400417200. PMID 15448150.
- ^ Райан Д.П., да Силва М.Р., Сунг Т.В., Фонтейн Б., Дональдсон М.Р., Кунг А.В., Чонджароенпрасерт В., Лян М.С., Кху Д.Х., Чеа Д.С., Хо С.К., Бернштейн HS, Масиэль Р.М., Браун Р.Х., Птачек Л.Дж. (январь 2010 г.) «Мутации в калиевом канале Kir2.6 вызывают предрасположенность к тиреотоксическому гипокалиемическому периодическому параличу». Клетка. 140 (1): 88–98. Дои:10.1016 / j.cell.2009.12.024. ЧВК 2885139. PMID 20074522.
дальнейшее чтение
Бертил Хилле (2001). Ионные каналы возбудимых мембран. 3-е изд. (Синауэр: Сандерленд, Массачусетс), стр. 149–154. ISBN 0-87893-321-2.
внешняя ссылка
- Внутрь + выпрямитель + калий + каналы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH).
- «Внутренне очищающиеся калиевые каналы». База данных рецепторов и ионных каналов IUPHAR. Международный союз фундаментальной и клинической фармакологии.
- UMich Ориентация белков в мембранах семьи / семья-85 - Пространственное положение внутренних выпрямительных калиевых каналов в мембранах.
