JADE1 - JADE1
JADE1 это белок что у людей кодируется JADE1 ген.[5][6][7][8]
Семья
Небольшое семейство белков под названием "Ген апоптоза и дифференциации" (JADE)[6] включает три члена, кодируемых отдельными генами: растительный гомеоден-17 (PHF17, JADE1), PHF16 (JADE3) и PHF15 (JADE2). Все белки семейства JADE несут два заметных домена средней молекулы: цинковый палец канонического растительного гомео-домена (PHD) и протяженный PHD-подобный цинковый палец. Таким образом, JADE1 классифицируется как член семейства белков PHD. Существует два известных белковых продукта гена PHF17, полноразмерный JADE1 (JADE1L) и его вариант сплайсинга, в котором отсутствует С-концевой фрагмент, также называемый короткой изоформой (JADE1S).
Открытие
Nagase et al. клонировали и секвенировали 100 отдельных кДНК из библиотеки кДНК головного мозга плода, включая клон KIAA1807, который был обозначен как PHF17.[9] Предсказанный белковый продукт из 702 аминокислот этого клона был подобен белку BR140 цинкового пальца человека (BRPF1).[10] Основываясь на анализе базы данных последовательностей, исследование показало, что PHF17 может функционировать в пути управления нуклеиновой кислотой.[9] В другом исследовании была выявлена кДНК, совпадающая с клоном KIAA1807, с использованием дрожжевого двухгибридного метода вытягивания для поиска новых партнеров белкового продукта гена Фон Хиппель Линдау (pVHL).[11] Белковый продукт этой кДНК получил название JADE1 (Jade-1, PHF17).[11] Выведенный белок длиной 509 аминокислот кДНК JADE1 был дополнительно подтвержден как физический партнер pVHL.[11] В ходе генетического скринингового исследования генов, участвующих в эмбриогенезе, был идентифицирован ортолог JADE1 мыши.[6] Это исследование предоставило первую характеристику гена JADE1 и определило новое семейство JADE. В исследовании были получены мыши с нокаутом гена JADE1.
Транскрипты Jade1 как у людей, так и у мышей подвергаются альтернативному сплайсингу и полиаденилированию с образованием двух основных транскриптов, полноразмерной мРНК 6 т.п.н. и мРНК 3,6 т.п.н.[6] Два результирующих белковых продукта гена JADE1 были обозначены как JADE1S для короткой (что аналогично (3)) и JADE1L для длинной изоформы. Также обнаружено несколько второстепенных транскриптов. Анализ базы данных выявил два дополнительных паралога JADE1 и членов семейства JADE, JADE2 и JADE3. JADE3 идентичен белку E9, идентифицированному в более раннем независимом исследовании, которое предполагает роль PHF16 / JADE3 / E9 в апоптозе в клетках рака молочной железы.[12]
JADE1 был отображен на хромосоме 4 (4q26-q27). JADE1 является консервативным, и его ортологи были обнаружены или предсказаны почти у каждого многоклеточного животного. Структура и последовательности генов, варианты, консервативность, ортологи и паралоги, филогенетическое дерево JADE1 и крупномасштабный скрининг тканевой экспрессии JADE1 можно найти в нескольких обширных базах данных (https://www.genecards.org; http://useast.ensembl.org ).
Структура
Полноразмерный полипептид JADE1 несет один канонический и один расширенный домены «цинковые пальцы» PHD.[13] Другие домены включают N-концевой кандидатный домен PEST, усилитель polycomb-подобного домена и сигнал C-концевой ядерной локализации (NLS).[6][11] (prosite.expasy.org). Белок JADE1 является мишенью для посттрансляционных модификаций, включая фосфорилирование (рис.
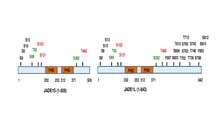
). Было идентифицировано, что шесть аминокислотных остатков фосфорилируются зависимым от клеточного цикла образом посредством Киназа Aurora A путь.[14][15] JADE1 является мишенью фосфорилирования Казеин киназа 2 (СК2).[16] Кроме того, множественные сайты фосфорилирования обнаруживаются с помощью подходов высокопроизводительного скрининга и анализа in silico. Сводная схема сайтов фосфорилирования белков JADE1L и JADE1S со ссылками находится в.[15]
Белки, несущие в тандеме канонический и расширенный PHD пальцы образуют небольшое подсемейство в большом семействе белков PHD (www.genenames.org). Другие белки, несущие тандем PHD-пальцев и связанные с JADE1, включают белки, которые являются компонентами связывающих хроматин и модифицирующих комплексов BRPF1, BRPF3, BRD1.[17] Кристаллическая структура доменов JADE1 PHD не решена. Канонический мотив пальца PHD имеет сигнатуру C4HC3, представляет собой относительно небольшую стабильную структуру и отличается от пальца RING типа C3HC4. Домены PHD способны распознавать и связывать специфический метилированный лизин гистона H3, что определяет эти домены как считыватели эпигенетического гистонового кода.[18][19][20] Доступны обзоры, подробно описывающие структуру и свойства пальцев PHD.[21][22][23][24]
Клеточная функция
Белки JADE1 многофункциональны и взаимодействуют с несколькими белками-партнерами.
Ацетилирование гистонов
Функция JADE1 в ацетилировании гистонов и активации транскрипции, которая требует второго удлиненного цинкового пальца PHD, была описана в 2004 г. (16). JADE1 резко увеличивает уровни ацетилированного гистона H4 в хроматине, но не гистона H3, что характерно для HAT TIP60 и HBO1 семейства MYST. TIP60 физически связывается с JADE1 и усиливает функцию JADE1 HAT в живых клетках. TIP60 и JADE1 взаимно стабилизировали друг друга. Транскрипционная и HAT-активность JADE1 требует PHD2. Результаты подтверждают роль JADE1 PHD2 в нацеливании на хроматин.[25] Кроме того, PHD2 из JADE1 связывает N-концевой хвост гистона H3 в контексте хроматина независимо от статуса метилирования.[26]
Исследования, посвященные анализу нативных комплексов белков семейства пальцев INhibitor of Growth (ING) PHD, показали, что белки ING4 и ING5 связаны с JADE1S и HAT HBO1,[27] в то время как ING3 связан с EPC1 (гомолог JADE1), TIP60 (гомолог HBO1) и несколькими другими партнерами. Оба комплекса также включали небольшой белок Eaf6. Биохимический и in silico анализ комплексов, образованных HBO1 и TIP60, предполагает общую архитектуру и подтверждает роль JADE1 в объемном ацетилировании гистона H4. Характеристика функциональных взаимодействий JADE1 и HBO1 показывает структурное и функциональное сходство между комплексами (16, 19). Подобно TIP60, JADE1 и HBO1 взаимно стабилизируют друг друга.[28] JADE1 связывается и позволяет HBO1 усиливать глобальное ацетилирование гистона H4, для чего требуется интактный палец PHD2.[28]Подобно HBO1, JADE1 отвечает за ацетилирование гистона H4 в культивируемых клетках. H4K5, H4K12 и, скорее всего, H4K8 являются мишенями JADE1-зависимого ацетилирования в культивируемых клетках и in vivo.[14][26][29]Несколько потенциальных мишеней транскрипции JADE1 были предложены в экспериментах с использованием подходов скрининга.[26][30] Согласно скрининговому геномному анализу, выполненному с помощью ChIP-chip assay, комплекс JADE1L обнаруживается в основном вдоль кодирующих областей многих генов, а численность JADE1L в основном коррелирует с H3K36me3 гистоновая метка. Избыточная экспрессия JADE1L коррелирует с повышенным количеством H4acK8 в кодирующей области многих генов.[26] Два цинковых пальца PHD JADE1, по-видимому, связывают преимущественно неметилированный N-концевой пептид гистона.[26][30][31]Изоформы JADE1 собирают по крайней мере два разных комплекса, JADE1L-HBO1-ING4 / 5 и комплекс JADE1S-HBO1.[28] Из-за отсутствия C-концевого фрагмента JADE1S неспособен связывать партнеров ING4 / 5.[28] Небольшой менее охарактеризованный белок Eaf6 также является другим компонентом комплексов JADE1.[30]
Клеточный цикл
Известно, что ацетилирование N-концевых фрагментов основного гистона H4 коррелирует с синтезом ДНК и делением клеток.[32][33][34][35][36] Несколько исследований подтверждают роль JADE1, связанного с путем HBO1, в клеточном цикле.[25][29] Оба, JADE1 и HBO1 независимо необходимы для ацетилирования основной массы гистона H4 в культивируемых клетках.[25][27][28][29] Истощение белков JADE1 с помощью siRNA приводит к 1) снижению уровней общего ацетилирования гистона H4; 2) более медленные темпы синтеза ДНК в культивируемых клетках;[29] 3) снижение уровня общего и связанного с хроматином HBO1;[28][29] 4) отмена рекрутирования MCM7 на хроматин.[29] В соответствии с этими результатами, сверхэкспрессия JADE1L увеличивает связанный с хроматином белок MCM3.[37] Эффекты истощения JADE1 на события репликации ДНК аналогичны эффектам, первоначально описанным для HBO1.[38] и предполагает роль адаптера для JADE1 в регуляции клеточного цикла, опосредованной HBO1.
Предполагается роль JADE1 в повреждении ДНК. Недавно обнаруженная некодирующая РНК lncRNA-JADE регулирует экспрессию JADE1 и обеспечивает функциональную связь между ответом на повреждение ДНК (DDR) и ацетилированием гистона H4.[39] Результаты подтверждают роль в синтезе ДНК, связанном с ацетилированием гистона H4.[39] В культивируемых клетках нокдаун lncRNA-JADE увеличивает чувствительность клеток к лекарствам, повреждающим ДНК. В модели ксенотрансплантата опухоли мышей нокдаун lncRNA-JADE ингибировал рост опухоли молочной железы на ксенотрансплантате. В пилотном исследовании на людях в тканях рака груди были обнаружены более высокие уровни lncRNA-JADE, а также белка JADE1 по сравнению с нормальными тканями. Наконец, более высокие уровни белка JADE1 обратно коррелировали с выживаемостью пациентов с раком груди. Исследование предполагает, что lncRNA-JADE может способствовать онкогенезу груди и что белок JADE1 опосредует, по крайней мере, часть этого эффекта.[39]JADE1 и цитокинез. JADE1S негативно регулирует цитокинез цикла эпителиальных клеток, функцию, специфичную для малой изоформы.[14][15] Первое сообщение, предполагающее функцию JADE1 в переходе G2 / M / G1, показало, что во время поздней фазы G2 JADE1S подвергается фосфорилированию, связанному с его диссоциацией из хроматина в цитоплазму. Масс-спектральный анализ показал, что всего шесть отдельных аминокислотных остатков фосфорилируются митотической киназой.[14] На основании фармакологического анализа фосфорилирование и компартментализация JADE1 регулируется путями Aurora A и Aurora B.[14][15] Сообщалось о других киназах, которые могут играть роль.[16][40] По завершении митоза вокруг телофазы основной пул белка JADE1S подвергается дефосфорилированию и повторно ассоциируется с очевидно конденсирующимся хроматином внутри реформированных ядер.[14] Дискретный пул JADE1S ассоциируется с бороздой дробления и впоследствии появляется в середине цитокинетического мостика.[15] Только JADE1S, но не JADE1L или HBO1, был обнаружен в среднем теле клеток, подвергающихся цитокинезу. Пространственная регуляция JADE1S во время клеточного деления предполагает роль в переходе от G2 / M к G1, который включает цитокинез и окончательное опадение.[15][41]Цитокинез - это заключительный этап клеточного цикла, который контролирует точность деления клеточного содержимого, включая цитоплазму, мембрану и хроматин. Цитокинетический мостик разрывается во время последнего опадения, которое происходит около середины тела и может занять до 2 часов. Цитокинез и окончательная абсциссия строго контролируются регуляторными белковыми комплексами и белками контрольных точек. Количество сообщений, касающихся контроля цитокинеза, росло за последнее десятилетие.[42][43][44][45][46]
Роль JADE1 в цитокинезе была продемонстрирована с помощью нескольких функциональных анализов и моделей клеточных культур.[15] Профилирование ДНК с помощью FACS показало, что истощение JADE1S способствует скорости накопления G1-клеток в синхронно делящихся клетках HeLa. Истощение белка JADE1S в асинхронно делящихся клетках уменьшало долю цитокинетических клеток и увеличивало долю многоядерных клеток. Данные продемонстрировали, что JADE1 отрицательно контролирует цитокинез, предположительно, способствуя задержке цитокинеза. Подавление JADE1 увеличивало количество многоядерных клеток, указывающих на нарушение цитокинеза, тогда как умеренная сверхэкспрессия JADE1S увеличивала количество цитокинетических клеток, указывающих на цитокинетическую задержку. Ингибирование киназы Aurora B специфическими низкомолекулярными лекарственными средствами приводило к высвобождению JADE1S-опосредованной цитокинетической задержки и позволяло прогрессировать абсциссию. Поскольку Aurora B является ключевым регулятором NoCut, JADE1S, вероятно, будет регулировать цитокинез в контрольной точке опущения.[15][41]JADE1S, но не JADE1L или HBO1, был обнаружен в центросомах делящихся клеток на протяжении клеточного цикла, и ни один из этих белков не был обнаружен в ресничках. Напротив, другое исследование сообщило о локализации JADE1 в ресничках и центросомах.[40] В исследовании не сообщалось о специфичности изоформы JADE1.[40] Центросомы являются центрами нуклеации цитоскелета. Передача сигналов центросом способствует определению формы клетки, подвижности, ориентации, полярности, плоскости деления и точности разделения сестринских хромосом во время митоза и цитокинеза.[47][48]
pVHL
Первый белковый партнер JADE1S был идентифицирован в 2002 году в исследовании поиска новых партнеров pVHL, который является супрессором опухолей.[11] Несколько последующих исследований охарактеризовали связывание и предоставили некоторую информацию о функциональных взаимодействиях JADE1-pVHL.[49][50][51]Человеческий pVHL мутирует при наследственном заболевании фон Хиппеля – Линдау и в большинстве спорадических светлоклеточных карцином почек.[52][53][54][55][56] Свойства и функции pVHL изучаются на протяжении многих десятилетий, и имеется обширная литература. Одна из наиболее известных функций pVHL - опосредовать убиквитинирование белка и протеосомную деградацию. Как компонент комплекса убиквитинлигазы E3, pVHL связывает и нацеливается на несколько известных факторов, включая HIF1a и HIF2a для убиквитинирования.[55] О механизме активации HIF1a гипоксией и роли pVHL в этом пути сообщалось более десяти лет назад.[57] Белок VHL интенсивно изучался, и была установлена связь естественных мутаций с раковыми заболеваниями. Были рассмотрены другие причинные HIF-1a-независимые пути pVHL.[58] Физическое взаимодействие pVHL-JADE1S было идентифицировано скрининговым анализом двух гибридных дрожжей и дополнительно подтверждено биохимически. Котрансфекция pVHL увеличивала период полужизни и количество белка JADE1S, что указывает на потенциальную положительную взаимосвязь.[11] Определенные усечения, вызванные раком pVHL, но не точечные мутации, снижают функцию стабилизации pVHL-JADE1, предполагая связь с pVHL-ассоциированным раком.[51]Молекулярные пути и клеточное значение взаимодействий JADE1-pVHL до конца не изучены. Об одном исследовании, описывающем внутреннюю активность убиквитин-лигазы JADE1S и убиквитинирование бета-катенина, было сообщено в 2008 году.[49] На основании этого исследования была предложена модель, согласно которой pVHL регулирует бета-катенин посредством JADE1, и для этой активности необходимы цинковые пальцы PHD.
Апоптоз
Была предложена функция JADE1S при апоптозе, но механизмы остаются неуловимыми и результаты трудно согласовать.[11][30][49][50][51] Согласно исследованиям, сверхэкспрессия JADE1 снижает скорость клеточного роста и индуцирует остановку клеточного цикла белка p21. Несколько попыток создать надежные клеточные линии, стабильно экспрессирующие белок JADE1S, не увенчались успехом, по-видимому, из-за негативного самотбора клеток. В отличие от этого, другое исследование показывает, что подавление JADE1 снижает скорость синтеза ДНК в синхронно делящихся клетках.[28][39] По данным непрямого иммунофлуоресцентного и микроскопического анализа культивируемых клеток, перегрузка культивируемых клеток белком JADE1 вызывает токсичность клеток и побочные эффекты.[15] Клетки претерпевают морфологические изменения, которые не похожи на апоптоз, но предполагают серьезное нарушение клеточного цикла, включая окрашивание клеток с аномальной формой и большими многодольчатыми ядрами.[15] На основании JADE1S-опосредованной регуляции клеточного цикла рассматриваются другие интерпретации: перегрузка JADE1 может вызывать длительный NoCut и остановленный цитокинез или серьезный дисбаланс клеточного цикла, а не прямую активацию транскрипции апоптоза.[15]
Биологическая роль
Биологическая роль JADE1 не выяснена. Ограниченное количество публикаций посвящено этому вопросу с использованием моделей мышей. Наиболее полное исследование, опубликованное в 2003 году, выявило у мышей ортолог JADE1 человека, Jade1, и исследовало экспрессию Jade1 во время эмбриогенеза мышей.[6] В поисках онтогенетически регулируемых генов авт. Использовали скрининговый анализ генных ловушек и идентифицировали Jade1 у мышей как ген, строго регулируемый во время эмбриогенеза. Вставка вектора в третий интрон гена Jade1 приводит к продукции укороченного белка из 47 аминокислот. Инсерционная мутация генной ловушки привела к образованию продукта слияния репортера Jade1-бета-галактозидазы и нулевого аллеля Jade1. В то время как гомозиготы для интеграции генных ловушек не давали сильного фенотипа развития, продукт слияния выявил пространственно-временную экспрессию гена Jade1 в эмбриональных клетках мыши и тканях развивающегося эмбриона до 15.5-d.p.c. Кроме того, в исследовании сообщается об экспериментальном и in silico сравнительном анализе транскриптов мРНК Jade1, структуре гена Jade1 и анализе ортологов белка Jade1 от мышей человека и рыб-данио.[6]Экспрессия Jade1 была обнаружена во внеэмбриональных эктодерма и трофобласты, которые являются компонентами плаценты, важными для васкулогенеза, а также в участках, обогащенных мультипотентными или тканеспецифическими предшественниками, включая нейральные предшественники (2). Динамика экспрессии репортера Jade1 в этих областях указывает на участие в детерминации и удлинении передней задней оси, что является важным моментом исследования).[6] Потенциальная роль человеческого JADE1 в обновлении культур эмбриональных стволовых клеток и клеток эмбриональной карциномы была предложена в другом скрининговом исследовании, которое показало, что в культивируемых стволовых клетках активация фактора транскрипции стволовых клеток 4 октября Этот путь активировал экспрессию гена JADE1 вместе с факторами стволовых клеток NANOG, PHC1, USP44 и SOX2.[59]Роль JADE1 в пролиферации эпителиальных клеток изучалась на мышиной модели острого повреждения и регенерации почек.[14][29] Паттерны экспрессии и динамика HBO1-JADE1S / L были исследованы в регенерирующих эпителиальных клетках канальцев.[29] Ишемия и реперфузионное повреждение привели к первоначальному снижению уровней белков JADE1S, JADE1L и HBO1, которые вернулись к исходному уровню во время восстановления почек. Уровни экспрессии HBO1 и JADE1S восстанавливались по мере того, как скорость пролиферации клеток достигала максимума, тогда как JADE1L восстанавливалась после того, как объемная пролиферация уменьшалась. Временная экспрессия JADE1 коррелирует с ацетилированием гистона H4 (H4K5 и H4K12), но не гистона H3 (H4K14), что позволяет предположить, что комплекс JADE1-HBO1 специфически маркирует H4 во время пролиферации эпителиальных клеток. Результаты исследования указывают на участие комплекса JADE1-HBO1 в остром повреждении почек и предполагают различные роли изоформ JADE1 во время восстановления эпителиальных клеток.[29]
Ассоциации болезней
Роль JADE1 в заболеваниях человека не выяснена. В недавнем исследовании проводился поиск новых генетических изменений под микроскопом при миелофиброзе, который является раком костного мозга.[60] Исследование выявило семь новых делеций и транслокаций в небольшой группе пациентов с первичным миелофиброзом. JADE1 и соседний ген, называемый натриевым каналом и клатриновым линкером 1 (SCLT1), были значительно изменены. В результате мутации ген JADE1 имеет делеции интрона 5-6 и экзонов 6-11, что приводит к образованию JADE1, в котором отсутствует большой кусок белка, начиная с цинкового пальца PHD. Связь с патогенезом изучается. В нескольких пилотных исследованиях экспрессия JADE1 изучалась при раке толстой кишки и карциноме почек. Результаты этих исследований не всегда совпадают. Результаты некоторых исследований получены в основном из гистохимического анализа образцов опухолей с использованием антитела JADE1 с не охарактеризованной специфичностью по отношению к JADE1 в целом и JADE1S или JADE1L в частности.[61][62] Результаты исследования с использованием алгоритма анализа микрочипов in silico показывают, что мРНК PHF17 может играть роль в развитии рака поджелудочной железы.[63] Эти многообещающие направления исследований требуют дальнейшего контроля и дополнительных оценок.
Взаимодействия
Некоторые белки взаимодействуют с JADE1, в том числе: pVHL,[11] TIP60,[25] ГБО1, ИНГ4, ИНГ5,[28] ß-катенин,[49] НПХП4.[40]
Примечания
Версия этой статьи 2016 года была обновлена внешним экспертом в соответствии с моделью двойной публикации. Соответствующие академическая экспертная оценка статья была опубликована в Ген и может быть процитирован как: Мария Панченко (4 мая 2016 г.), «Строение, функция и регуляция нефритового семейства PHD finger 1 (JADE1).», Ген, 589 (1): 1–11, Дои:10.1016 / J.GENE.2016.05.002, ISSN 0378-1119, ЧВК 4903948, PMID 27155521, Викиданные Q38828242 |
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000077684 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000025764 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Нагасе Т., Накаяма М., Накадзима Д., Кикуно Р., Охара О. (апрель 2001 г.). «Прогнозирование кодирующих последовательностей неидентифицированных генов человека. XX. Полные последовательности 100 новых клонов кДНК из мозга, которые кодируют большие белки in vitro». ДНК исследования. 8 (2): 85–95. Дои:10.1093 / днарес / 8.2.85. PMID 11347906.
- ^ а б c d е ж грамм час Tzouanacou E, Tweedie S, Wilson V (декабрь 2003 г.). «Идентификация Jade1, гена, кодирующего белок цинкового пальца PHD, в скрининге мутагенеза генной ловушки для генов, участвующих в развитии переднезадней оси». Молекулярная и клеточная биология. 23 (23): 8553–2. Дои:10.1128 / mcb.23.23.8553-8562.2003. ЧВК 262661. PMID 14612400.
- ^ Чжоу М.И., Ван Х., Росс Дж. Дж., Кузьмин И., Сюй С., Коэн Х. Т. (октябрь 2002 г.). «Подавитель опухолей фон Хиппеля-Линдау стабилизирует новый растительный гомеодоменный белок Jade-1». Журнал биологической химии. 277 (42): 39887–98. Дои:10.1074 / jbc.M205040200. PMID 12169691.
- ^ «Ген Entrez: PHF17 PHD палец-протеин 17».
- ^ а б Нагасе Т., Накаяма М., Накадзима Д., Кикуно Р., Охара О. (апрель 2001 г.). «Прогнозирование кодирующих последовательностей неидентифицированных генов человека. XX. Полные последовательности 100 новых клонов кДНК из мозга, которые кодируют большие белки in vitro». ДНК исследования. 8 (2): 85–95. Дои:10.1093 / днарес / 8.2.85. PMID 11347906.
- ^ Томпсон К.А., Ван Б., Аргрейвс В.С., Джанкотти Ф.Г., Шранк Д.П., Руослахти Э. (февраль 1994 г.). «BR140, новый белок цинкового пальца, гомологичный субъединице TAF250 TFIID». Сообщения о биохимических и биофизических исследованиях. 198 (3): 1143–52. Дои:10.1006 / bbrc.1994.1162. PMID 7906940.
- ^ а б c d е ж грамм час Чжоу М.И., Ван Х., Росс Дж. Дж., Кузьмин И., Сюй С., Коэн Х. Т. (октябрь 2002 г.). «Подавитель опухолей фон Хиппеля-Линдау стабилизирует новый растительный гомеодоменный белок Jade-1». Журнал биологической химии. 277 (42): 39887–98. Дои:10.1074 / jbc.M205040200. PMID 12169691.
- ^ Szelei J, Soto AM, Geck P, Desronvil M, Prechtl NV, Weill BC, Sonnenschein C (март 2000 г.). «Идентификация человеческих эстроген-индуцибельных транскриптов, которые потенциально опосредуют апоптотический ответ при раке груди». Журнал стероидной биохимии и молекулярной биологии. 72 (3–4): 89–102. Дои:10.1016 / с0960-0760 (00) 00025-х. PMID 10775800. S2CID 25912630.
- ^ «Протеин Джейд-1 (Q6IE81)». ИнтерПро.
- ^ а б c d е ж грамм Сиривардана Н.С., Мейер Р., Хаваси А., Домингес И., Панченко М.В. (2014). «Зависящее от клеточного цикла перемещение хроматина комплекса гистонацетилтрансферазы (HAT) HBO1-JADE1». Клеточный цикл. 13 (12): 1885–901. Дои:10.4161 / cc.28759. ЧВК 4111752. PMID 24739512.
- ^ а б c d е ж грамм час я j k Сиривардана Н.С., Мейер Р.Д., Панченко М.В. (2015). «Новая функция JADE1S в цитокинезе эпителиальных клеток». Клеточный цикл. 14 (17): 2821–34. Дои:10.1080/15384101.2015.1068476. ЧВК 4612376. PMID 26151225.
- ^ а б Боргал Л., Риншен М.М., Дафингер С., Хофф С., Райнерт М.Дж., Ламкемейер Т., Лиенкамп С.С., Бенцинг Т., Шермер Б. (сентябрь 2014 г.). «Казеинкиназа 1 α фосфорилирует регулятор Wnt Jade-1 и модулирует его активность». Журнал биологической химии. 289 (38): 26344–56. Дои:10.1074 / jbc.M114.562165. ЧВК 4176241. PMID 25100726.
- ^ "JADE1 - Поиск - Homo sapiens - Обозреватель генома ансамбля 84".
- ^ Wysocka J, Swigut T, Xiao H, Milne TA, Kwon SY, Landry J, Kauer M, Tackett AJ, Chait BT, Badenhorst P, Wu C, Allis CD (июль 2006 г.). "Палец PHD NURF связывает триметилирование лизина 4 гистона H3 с ремоделированием хроматина". Природа. 442 (7098): 86–90. Bibcode:2006 Натур 442 ... 86 Вт. Дои:10.1038 / природа04815. PMID 16728976. S2CID 4389087.
- ^ Ши X, Хонг Т., Уолтер К.Л., Эвалт М., Мичишита Э, Хунг Т., Карни Д., Пенья П., Лан Ф, Каадидже М.Р., Лакосте Н., Кайру С., Давразу Ф., Саха А., Кэрнс Б.Р., Айер Д.Е., Кутателадзе Т.Г. , Ши И, Коте Дж, Чуа К.Ф., Гозани О. (июль 2006 г.). «Домен ING2 PHD связывает метилирование лизина 4 гистона H3 с активной репрессией гена». Природа. 442 (7098): 96–9. Bibcode:2006Натура 442 ... 96С. Дои:10.1038 / природа04835. ЧВК 3089773. PMID 16728974.
- ^ Taverna SD, Ilin S, Rogers RS, Tanny JC, Lavender H, Li H, Baker L, Boyle J, Blair LP, Chait BT, Patel DJ, Aitchison JD, Tackett AJ, Allis CD (декабрь 2006 г.). «Связывание пальца Yng1 PHD с H3, триметилированным по K4, способствует активности NuA3 HAT в K14 H3 и транскрипции в подмножестве нацеленных ORF». Молекулярная клетка. 24 (5): 785–96. Дои:10.1016 / j.molcel.2006.10.026. ЧВК 4690528. PMID 17157260.
- ^ Санчес Р., Чжоу М.М. (июль 2011 г.). «Палец PHD: универсальный считыватель эпигеномов». Тенденции в биохимических науках. 36 (7): 364–72. Дои:10.1016 / j.tibs.2011.03.005. ЧВК 3130114. PMID 21514168.
- ^ Кван А.Х., Гелл Д.А., Вергер А., Кроссли М., Мэтьюз Дж. М., Маккей Дж. П. (июль 2003 г.). «Разработка белкового каркаса из пальца PHD». Структура. 11 (7): 803–13. Дои:10.1016 / s0969-2126 (03) 00122-9. PMID 12842043.
- ^ Mansfield RE, Musselman CA, Kwan AH, Oliver SS, Garske AL, Davrazou F, Denu JM, Kutateladze TG, Mackay JP (апрель 2011 г.). «Пальцы растительного гомеодомена (PHD) CHD4 представляют собой гистоновые H3-связывающие модули с предпочтением немодифицированному H3K4 и метилированному H3K9». Журнал биологической химии. 286 (13): 11779–91. Дои:10.1074 / jbc.M110.208207. ЧВК 3064229. PMID 21278251.
- ^ Мэтьюз Дж. М., Бхати М., Лехтомаки Э., Мэнсфилд Р. Э., Кубедду Л., Маккей Дж. П. (2009). «Для танго нужны два: структура и функция доменов LIM, RING, PHD и MYND». Текущий фармацевтический дизайн. 15 (31): 3681–96. Дои:10.2174/138161209789271861. PMID 19925420.
- ^ а б c d Панченко М.В., Чжоу М.И., Коэн Х.Т. (декабрь 2004 г.). «Партнер фон Хиппеля-Линдау Jade-1 представляет собой коактиватор транскрипции, связанный с активностью гистонацетилтрансферазы». Журнал биологической химии. 279 (53): 56032–41. Дои:10.1074 / jbc.M410487200. PMID 15502158.
- ^ а б c d е Saksouk N, Avvakumov N, Champagne KS, Hung T, Doyon Y, Cayrou C, Paquet E, Ullah M, Landry AJ, Côté V, Yang XJ, Gozani O, Kutateladze T.G., Côté J (январь 2009 г.). «Комплексы HBO1 HAT нацелены на хроматин во всех кодирующих областях гена посредством множественных взаимодействий PHD-пальцев с хвостом гистона H3». Молекулярная клетка. 33 (2): 257–65. Дои:10.1016 / j.molcel.2009.01.007. ЧВК 2677731. PMID 19187766.
- ^ а б Дойон И., Кайру С., Уллах М., Ландри А.Дж., Кот Ви, Селлек В., Лейн В.С., Тан С., Ян XJ, Кот Дж. (Январь 2006 г.). «Белки-супрессоры опухолей ING являются критическими регуляторами ацетилирования хроматина, необходимыми для экспрессии и сохранения генома». Молекулярная клетка. 21 (1): 51–64. Дои:10.1016 / j.molcel.2005.12.007. PMID 16387653.
- ^ а б c d е ж грамм час Фой Р.Л., Сонг IY, Читалия В.К., Коэн Х.Т., Саксук Н., Кайру С., Вазири С., Кот Дж., Панченко М.В. (октябрь 2008 г.). «Роль Jade-1 в комплексе гистонацетилтрансферазы (HAT) HBO1». Журнал биологической химии. 283 (43): 28817–26. Дои:10.1074 / jbc.M801407200. ЧВК 2570895. PMID 18684714.
- ^ а б c d е ж грамм час я Хаваси А., Хэгеле Дж. А., Галл Дж. М., Блэкмон С., Ичимура Т., Бонегио Р. Г., Панченко М. В. (январь 2013 г.). «Гистонацетилтрансфераза (HAT) HBO1 и JADE1 в регенерации эпителиальных клеток». Американский журнал патологии. 182 (1): 152–62. Дои:10.1016 / j.ajpath.2012.09.017. ЧВК 3532714. PMID 23159946.
- ^ а б c d Аввакумов Н., Лалонд М.Э., Саксук Н., Паке Э., Гласс К.С., Ландри А.Дж., Дойон Ю., Кайру С., Робитайль Г.А., Ричард Д.Э., Ян XJ, Кутателадзе Т.Г., Коте Дж. (Февраль 2012 г.). «Консервативные молекулярные взаимодействия в комплексах ацетилтрансферазы HBO1 регулируют пролиферацию клеток». Молекулярная и клеточная биология. 32 (3): 689–703. Дои:10.1128 / MCB.06455-11. ЧВК 3266594. PMID 22144582.
- ^ Лалонд М.Э., Аввакумов Н., Гласс К.С., Йонкас Ф.Х., Саксук Н., Холлидей М., Паке Э., Ян К., Тонг Кью, Кляйн Б.Дж., Тан С., Ян XJ, Кутателадзе Т.Г., Кот Дж. (Сентябрь 2013 г.). «Обмен ассоциированными факторами управляет переключением специфичности гистонового хвоста ацетилтрансферазы HBO1». Гены и развитие. 27 (18): 2009–24. Дои:10.1101 / gad.223396.113. ЧВК 3792477. PMID 24065767.
- ^ Megee PC, Morgan BA, Smith MM (июль 1995 г.). «Гистон H4 и поддержание целостности генома». Гены и развитие. 9 (14): 1716–27. Дои:10.1101 / gad.9.14.1716. PMID 7622036.
- ^ Маки Н., Цонис П.А., Агата К. (16 сентября 2010 г.). «Изменения глобальных модификаций гистонов во время дедифференцировки при регенерации хрусталика тритона». Молекулярное зрение. 16: 1893–7. ЧВК 2956703. PMID 21031136.
- ^ Ясенчакова З., Мейстер А., Вальтер Дж., Тернер Б.М., Шуберт I (ноябрь 2000 г.). «Ацетилирование гистоном H4 эухроматина и гетерохроматина зависит от клеточного цикла и коррелирует с репликацией, а не с транскрипцией». Растительная клетка. 12 (11): 2087–100. Дои:10.1105 / tpc.12.11.2087. ЧВК 150160. PMID 11090211.
- ^ Кларк А.С., Лоуэлл Дж. Э., Якобсон С. Дж., Пиллус Л. (апрель 1999 г.). «Esa1p - это важная гистонацетилтрансфераза, необходимая для развития клеточного цикла». Молекулярная и клеточная биология. 19 (4): 2515–26. Дои:10.1128 / mcb.19.4.2515. ЧВК 84044. PMID 10082517.
- ^ Choy JS, Tobe BT, Huh JH, Kron SJ (ноябрь 2001 г.). «Yng2p-зависимая активность ацетилирования гистона H4 NuA4 необходима для митотической и мейотической прогрессии». Журнал биологической химии. 276 (47): 43653–62. Дои:10.1074 / jbc.M102531200. PMID 11544250.
- ^ Miotto B, Struhl K (январь 2010 г.). «Гистонацетилазная активность HBO1 необходима для лицензирования репликации ДНК и ингибируется Геминином». Молекулярная клетка. 37 (1): 57–66. Дои:10.1016 / j.molcel.2009.12.012. ЧВК 2818871. PMID 20129055.
- ^ Иидзука М., Мацуи Т., Такисава Х., Смит М.М. (февраль 2006 г.). «Регулирование лицензирования репликации ацетилтрансферазой Hbo1». Молекулярная и клеточная биология. 26 (3): 1098–108. Дои:10.1128 / MCB.26.3.1098-1108.2006. ЧВК 1347032. PMID 16428461.
- ^ а б c d Ван Джи, Ху Х, Лю И, Хан Ц, Суд А.К., Калин Г.А., Чжан Х, Лю Х (октябрь 2013 г.). «Новая некодирующая РНК lncRNA-JADE связывает сигнализацию повреждения ДНК с ацетилированием гистона H4». Журнал EMBO. 32 (21): 2833–47. Дои:10.1038 / emboj.2013.221. ЧВК 3817469. PMID 24097061.
- ^ а б c d Borgal L, Habbig S, Hatzold J, Liebau MC, Dafinger C, Sacarea I, Hammerschmidt M, Benzing T., Schermer B (июль 2012 г.). «Цилиарный белок нефроцистин-4 перемещает канонический регулятор Wnt Jade-1 в ядро, чтобы негативно регулировать передачу сигналов β-катенина». Журнал биологической химии. 287 (30): 25370–80. Дои:10.1074 / jbc.M112.385658. ЧВК 3408186. PMID 22654112.
- ^ а б Прекерис Р. (2015). «Cut or NoCut: роль JADE1S в регулировании контрольной точки отсечения». Клеточный цикл. 14 (20): 3219. Дои:10.1080/15384101.2015.1089074. ЧВК 4825624. PMID 26327571.
- ^ Агромайор М., Мартин-Серрано Дж. (Сентябрь 2013 г.). «Знание, когда резать и бегать: механизмы, контролирующие цитокинетическое падение». Тенденции в клеточной биологии. 23 (9): 433–41. Дои:10.1016 / j.tcb.2013.04.006. PMID 23706391.
- ^ Элиа Н., Суграт Р., Спурлин Т.А., Херли Дж. Х., Липпинкотт-Шварц Дж. (Март 2011 г.). «Динамика эндосомального сортировочного комплекса, необходимого для транспорта (ESCRT) во время цитокинеза, и его роль в опадении». Труды Национальной академии наук Соединенных Штатов Америки. 108 (12): 4846–51. Bibcode:2011PNAS..108.4846E. Дои:10.1073 / pnas.1102714108. ЧВК 3064317. PMID 21383202.
- ^ Фаббро М., Чжоу Б.Б., Такахаши М., Сарчевич Б., Лал П., Грэм М.Э., Габриелли Б.Г., Робинсон П.Дж., Нигг Е.А., Оно Ю., Ханна К.К. (октябрь 2005 г.). «Cdk1 / Erk2- и Plk1-зависимое фосфорилирование белка центросомы, Cep55, необходимо для его привлечения к среднему телу и цитокинезу». Клетка развития. 9 (4): 477–88. Дои:10.1016 / j.devcel.2005.09.003. PMID 16198290.
- ^ Green RA, Paluch E, Oegema K (2012). «Цитокинез в клетках животных». Ежегодный обзор клеточной биологии и биологии развития. 28: 29–58. Дои:10.1146 / annurev-cellbio-101011-155718. PMID 22804577.
- ^ Ху СК, Кафлин М., Митчисон Т.Дж. (март 2012 г.). «Сборка среднего тела и его регуляция во время цитокинеза». Молекулярная биология клетки. 23 (6): 1024–34. Дои:10.1091 / mbc.E11-08-0721. ЧВК 3302730. PMID 22278743.
- ^ Нигг Е.А., Стернс Т. (октябрь 2011 г.). «Цикл центросом: биогенез центриолей, дупликация и врожденные асимметрии». Природа клеточной биологии. 13 (10): 1154–60. Дои:10.1038 / ncb2345. ЧВК 3947860. PMID 21968988.
- ^ Слудер Г., Ходжаков А. (декабрь 2010 г.). «Дублирование центриолей: аналоговое управление в цифровую эпоху». Cell Biology International. 34 (12): 1239–45. Дои:10.1042 / CBI20100612. ЧВК 3051170. PMID 21067522.
- ^ а б c d Читалия В.К., Фой Р.Л., Бахшмид М.М., Цзэн Л., Панченко М.В., Чжоу М.И., Бхарти А., Селдин, округ Колумбия, Лекер С.Х., Домингес И., Коэн Х.Т. (октябрь 2008 г.). «Jade-1 ингибирует передачу сигналов Wnt посредством убиквитилирования бета-катенина и опосредует ингибирование пути Wnt с помощью pVHL». Природа клеточной биологии. 10 (10): 1208–16. Дои:10.1038 / ncb1781. ЧВК 2830866. PMID 18806787.
- ^ а б Чжоу М.И., Фой Р.Л., Читалия В.К., Чжао Дж., Панченко М.В., Ван Х., Коэн Х.Т. (август 2005 г.). «Джейд-1, кандидат в супрессор почечных опухолей, способствующий апоптозу». Труды Национальной академии наук Соединенных Штатов Америки. 102 (31): 11035–40. Bibcode:2005PNAS..10211035Z. Дои:10.1073 / pnas.0500757102. ЧВК 1182408. PMID 16046545.
- ^ а б c Чжоу М.И., Ван Х., Фой Р.Л., Росс Дж.Дж., Коэн Х.Т. (февраль 2004 г.). «Стабилизация белка Jade-1 с помощью опухолевого супрессора фон Хиппеля-Линдау (VHL) происходит через гомеодомены растений и зависит от мутации VHL». Исследования рака. 64 (4): 1278–86. Дои:10.1158 / 0008-5472.can-03-0884. PMID 14973063.
- ^ Crossey PA, Richards FM, Foster K, Green JS, Prowse A, Latif F, Lerman MI, Zbar B, Affara NA, Ferguson-Smith MA (август 1994). «Идентификация внутригенных мутаций в гене-супрессоре опухоли болезни фон Хиппеля-Линдау и корреляция с фенотипом болезни». Молекулярная генетика человека. 3 (8): 1303–8. Дои:10,1093 / hmg / 3.8.1303. PMID 7987306.
- ^ Фостер К., Проуз А., ван ден Берг А., Флеминг С., Хулсбек М. М., Кросси П. А., Ричардс Ф. М., Кэрнс П., Аффара Н. А., Фергюсон-Смит М. А. (декабрь 1994 г.). "Соматические мутации гена супрессора опухоли болезни фон Гиппеля-Линдау в несемейной светлоклеточной карциноме почек". Молекулярная генетика человека. 3 (12): 2169–73. Дои:10.1093 / hmg / 3.12.2169. PMID 7881415.
- ^ Дуан Д.Р., Хамфри Дж. С., Чен Д. Ю., Вен Й., Сукегава Дж., Ли С., Гнарра Дж. Р., Линехан В. М., Клауснер Р. Д. (июль 1995 г.). «Характеристика продукта гена-супрессора опухоли VHL: локализация, комплексообразование и влияние естественных инактивирующих мутаций». Труды Национальной академии наук Соединенных Штатов Америки. 92 (14): 6459–63. Bibcode:1995PNAS ... 92.6459D. Дои:10.1073 / пнас.92.14.6459. ЧВК 41537. PMID 7604013.
- ^ а б Максвелл PH, Визенер MS, Чанг GW, Клиффорд SC, Vaux EC, Cockman ME, Wykoff CC, Pugh CW, Maher ER, Ratcliffe PJ (май 1999). «Белок-супрессор опухолей VHL нацелен на индуцируемые гипоксией факторы кислород-зависимого протеолиза». Природа. 399 (6733): 271–5. Bibcode:1999Натура.399..271М. Дои:10.1038/20459. PMID 10353251. S2CID 4427694.
- ^ Латиф Ф., Тори К., Гнарра Дж., Яо М., Ду Ф.М., Оркатт М.Л., Стакхаус Т., Кузьмин И., Моди В., Гейл Л. (май 1993 г.). «Идентификация гена-супрессора опухоли болезни фон Гиппеля-Линдау». Наука. 260 (5112): 1317–20. Bibcode:1993Научный ... 260.1317L. Дои:10.1126 / наука.8493574. PMID 8493574.
- ^ Jaakkola P, Mole DR, Tian YM, Wilson MI, Gielbert J, Gaskell SJ, von Kriegsheim A, Hebestreit HF, Mukherji M, Schofield CJ, Maxwell PH, Pugh CW, Ratcliffe PJ (апрель 2001 г.). «Нацеливание HIF-альфа на комплекс убиквитилирования фон Хиппеля-Линдау с помощью O2-регулируемого гидроксилирования пролила». Наука. 292 (5516): 468–72. Bibcode:2001Sci ... 292..468J. Дои:10.1126 / science.1059796. PMID 11292861. S2CID 20914281.
- ^ Госсейдж Л., Эйзен Т., Махер Э.Р. (январь 2015 г.). «ВХЛ, история гена-супрессора опухолей». Обзоры природы. Рак. 15 (1): 55–64. Дои:10.1038 / nrc3844. PMID 25533676. S2CID 19312746.
- ^ Юнг М., Петерсон Х., Чавес Л., Калем П., Лехрах Х., Вило Дж., Аджай Дж. (21 мая 2010 г.). «Подход интеграции данных для картирования регуляторных сетей генов OCT4, действующих в эмбриональных стволовых клетках и клетках эмбриональной карциномы». PLOS ONE. 5 (5): e10709. Bibcode:2010PLoSO ... 510709J. Дои:10.1371 / journal.pone.0010709. ЧВК 2873957. PMID 20505756.
- ^ Лашо Т., Джонсон С.Х., Смит Д.И., Криспино Д.Д., Парданани А., Васматцис Г., Теффери А. (сентябрь 2013 г.). «Идентификация субмикроскопических генетических изменений и точное картирование контрольных точек при миелофиброзе с использованием секвенирования пары спарившихся с высоким разрешением». Американский журнал гематологии. 88 (9): 741–6. Дои:10.1002 / ajh.23495. PMID 23733509. S2CID 5232311.
- ^ Лиан Х, Дуань Х, Ву Х, Ли Ц, Чен С., Ван С., Цай И, Вен З (август 2012 г.). «Экспрессия и клиническое значение нижестоящих генов фон Хиппель-Линдау: Jade-1 и β-катенин, связанные с почечно-клеточной карциномой». Урология. 80 (2): 485.e7–13. Дои:10.1016 / j.urology.2012.02.024. PMID 22516360.
- ^ Лим С.Р., Гуи Б.Х., Сингх М., Гам Л.Х. (ноябрь 2011 г.). «Анализ дифференциально экспрессируемых белков при колоректальном раке с использованием колонки с гидроксиапатитом и SDS-PAGE». Прикладная биохимия и биотехнология. 165 (5–6): 1211–24. Дои:10.1007 / s12010-011-9339-3. PMID 21863284. S2CID 13272576.
- ^ Лю П.Ф., Цзян У.Х., Хан Ю.Т., Хе Л.Ф., Чжан Х.Л., Рен Х. (28 августа 2015 г.). «Комплексный анализ микроРНК-мРНК аденокарциномы протока поджелудочной железы». Генетика и молекулярные исследования. 14 (3): 10288–97. Дои:10.4238 / 2015. 28 августа.. PMID 26345967.
дальнейшее чтение
- Tzouanacou E, Tweedie S, Wilson V (декабрь 2003 г.). «Идентификация Jade1, гена, кодирующего белок цинкового пальца PHD, в скрининге мутагенеза генной ловушки для генов, участвующих в развитии переднезадней оси». Молекулярная и клеточная биология. 23 (23): 8553–2. Дои:10.1128 / MCB.23.23.8553-8562.2003. ЧВК 262661. PMID 14612400.
- Панченко М.В., Чжоу М.И., Коэн Х.Т. (декабрь 2004 г.). «Партнер фон Хиппеля-Линдау Jade-1 представляет собой коактиватор транскрипции, связанный с активностью гистонацетилтрансферазы». Журнал биологической химии. 279 (53): 56032–41. Дои:10.1074 / jbc.M410487200. PMID 15502158.
- Чжоу М.И., Фой Р.Л., Читалия В.К., Чжао Дж., Панченко М.В., Ван Х., Коэн Х.Т. (август 2005 г.). «Нефрит-1, кандидат в супрессор почечных опухолей, способствующий апоптозу». Труды Национальной академии наук Соединенных Штатов Америки. 102 (31): 11035–40. Bibcode:2005PNAS..10211035Z. Дои:10.1073 / pnas.0500757102. ЧВК 1182408. PMID 16046545.
- Дойон И., Кайру С., Улла М., Ландри А.Дж., Кот Ви, Селлек В., Лейн В.С., Тан С., Ян XJ, Кот Дж. (Январь 2006 г.). «Белки-супрессоры опухолей ING являются критическими регуляторами ацетилирования хроматина, необходимыми для экспрессии и сохранения генома». Молекулярная клетка. 21 (1): 51–64. Дои:10.1016 / j.molcel.2005.12.007. PMID 16387653.
- Лим Дж., Хао Т., Шоу С., Патель А.Дж., Сабо Дж., Руал Дж. Ф., Фиск С.Дж., Ли Н., Смоляр А., Хилл Д.Е., Барабаши А.Л., Видал М., Зогби Х.Й. (май 2006 г.). «Сеть межбелкового взаимодействия для унаследованных атаксий человека и нарушений дегенерации клеток Пуркинье». Клетка. 125 (4): 801–14. Дои:10.1016 / j.cell.2006.03.032. PMID 16713569. S2CID 13709685.
- Олсен Дж. В., Благоев Б., Гнад Ф, Мацек Б., Кумар С., Мортенсен П., Манн М. (ноябрь 2006 г.). «Глобальная, in vivo и сайт-специфическая динамика фосфорилирования в сигнальных сетях». Клетка. 127 (3): 635–48. Дои:10.1016 / j.cell.2006.09.026. PMID 17081983. S2CID 7827573.
внешняя ссылка
- PHF17 + белок, + человеческий в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.