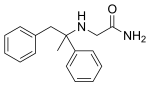
Ремасемид - Remacemide
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Ecovia[1] |
| Другие имена | (±) -2-амино-N- [1,2-ди (фенил) пропан-2-ил] ацетамидPR 934-423 |
| Маршруты администрация | устный |
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C17ЧАС20N2О |
| Молярная масса | 268.360 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Ремасемид это препарат, средство, медикамент который действует как низкое сродство Антагонист NMDA с натрий канал блокирующие свойства.[2] Он был изучен для лечения острого ишемический приступ,[3][4] эпилепсия,[5] болезнь Хантингтона, и болезнь Паркинсона.
Ремасемид оказывает незначительное влияние на частоту приступов и их причины. головокружение, больше не считается, что ремасемид будет эффективным средством лечения эпилепсии.[6] Хотя не было сделано никаких заявлений о возможностях ремасемида для лечения инсульта, болезни Хантингтона или Паркинсона, ремасемид больше не разрабатывается для этих состояний.[нужна цитата ]
Ремасемид также известен как гидрохлорид ремасемида, (±) -2-амино-N- (1-метил-1,2-дифенилэтил) ацетамида гидрохлорид или FPL 12924AA.[7]
Побочные эффекты
Отсутствие побочных эффектов
В отличие от многих других методов лечения эпилепсии, ремасемид не ухудшает когнитивные функции.[9][10][11] или ходовые качества[12] у людей, хотя данные о влиянии на когнитивные способности животных неоднозначны.[13][14][15][16][17] Ремасемид не является седативным средством.[18]
Токсичность
В средняя токсическая доза Ремасемида для тестов на нервную недостаточность у мышей составляет 5,6 мг / кг.[18]По оценкам средняя смертельная доза составляет около 927,3 мг / кг у мышей.[18]Имеет благоприятный терапевтический индекс 28,1 у мышей.[18]
Лекарственные взаимодействия
Леводопа
Ремасемид задерживает всасывание леводопа (300 мг ремасемида за час до лечения леводопой задерживают среднее время до максимальной концентрации леводопы в плазме на 20%), но не его полное всасывание (площадь под кривой для концентрации леводопы в плазме не изменилась).[19]
Вальпроат натрия
Ремасемид не взаимодействует с вальпроат натрия, лечение эпилепсии.[20]
Карбамазепин
Рамасемид взаимодействует с карбамазепин. Ремасемид подавляет метаболизм карбамазепина, тогда как карбамазепин индуцирует метаболизм ремасемида и FPL 12495.[21]
Алкоголь
Ремасемидные соли
Ремасемид чаще всего синтезируется в виде соль ремасемида гидрохлорид. Однако было проведено некоторое исследование других солей ремасемида и их кристаллы, поскольку различные соли ремасемида могут быть более приятными на вкус или иметь растворимость больше подходит для педиатрии приостановка формулировка.[22]
Механизм действия
Ремасемид слабо связывается и неконкурентно к участку ионного канала NMDA рецепторный комплекс.[7] Ремасемид связывается как аллостерически, так и в канале.[23] Однако, поскольку ремасемид так слабо связывается с NMDAR, большая часть ремасемида in vivo эффект против эксайтотоксичность считается, что это вызвано его метаболическим превращением в более мощное производное дезглицина FPL 12495.[7] То есть ремасемид действительно может действовать как пролекарство доставить активный метаболит FPL 12495 для центральной нервной системы.[24]
Эпилепсия
На хорошо проверенной и описанной генетической модели абсанс-эпилепсии было обнаружено, что крысы линии WAG / Rij, ремасемид и его метаболит FPL 12495 имеют общий для антагонистов глутамата обычный эффект на количество спайк-волновых разрядов.ЭЭГ препараты уменьшают выбросы пиков / волн в зависимости от дозы. Однако, в отличие от большинства других антагонистов глутамата, FPL 12495 увеличивал продолжительность спайк-волновых разрядов.[25]
Фармакокинетика
Гематоэнцефалический барьер
Индекс усвоения мозгом (BUI), мера способности лекарства проходить гематоэнцефалический барьер что включает в себя введение радиоактивно меченый тестовые и эталонные вещества в общая сонная артерия животных под наркозом,[26][27] для ремасемида - 51 ± 0,9 стандартное отклонение.[24]
Энантиомеры
В (-)стереоизомер Ремасемид обладает равной эффективностью с рацемической смесью в предотвращении максимальных приступов электрошока при пероральном введении крысам, в то время как (+) стереоизомер менее эффективен.[28]
Метаболиты
FPL 12495
Большая часть эффекта ремасемида in vivo считается, что это вызвано производным дезглицина FPL 12495 (±).[7]FPL 12495 (±) специфически и неконкурентно связывается с NMDAR.[29] Его влияние на максимальный электросудорожный шок более мощный чем ремасемид.[7] В S изомер (FPL 12859) даже более мощный, чем рацемическая смесь, в то время как R-изомер менее активен, чем рацемат.[7]
FPL 12495 иногда обозначается как ARL 12495AA.[30][31][32]
Другие метаболиты
FPL 15053
FPL 15053 - это N-гидроксидезглицинат ремасемида и проявляет умеренное связывание с NMDAR и умеренное воздействие на судороги и смертность у подопытных мышей и крыс.[7]
FPL 14331 и FPL 14465
FPL 14331 и FPL 14465 являются п-гидроксидезглицинаты ремасемида, и они проявляют некоторую эффективность против максимального электросудорожного шока после внутрибрюшинного введения. и i.v. дозирование.[7]
FPL 15455
FPL 15455 представляет собой оксоацетатный матаболит ремасемида, но не имеет продемонстрированной биологической активности.[7]
FPL 14991 и FPL 14981
FPL 14991 и FPL 14981 оба являются β-Мийдроксидезглицинаты ремасемида, и они демонстрируют умеренную эффективность против максимального электросудорожного шока у мышей.[7] Однако FPL 14981, а не FPL 14991, предотвращает вызванные NMDLA судороги и смертность у мышей.[7]
FPL 13592 и FPL 15112
Гидроксиметильное производное ремасемида (FPL 13592) и его дезглицинат (FPL 15112) предотвращают судороги, вызванные электрическим током, только после внутривенного введения. администрация; только производное дезглицина связывается с NMDAR.[7]
FPL 14467
FPL 14467 (п-дигидрокси-дезглицин) неактивен in vivo и слабый в связывании NMDAR.[7]
Фармакодинамика
В значения для смещения 50% из [3H] MK801 составляли 68 мкМ для ремасемида и 0,48 мкМ для FPL 12495AA.[7]
История
Текущее состояние
Ремасемид - это экспериментальный препарат последний раз был разработан британской многонациональной фармацевтическая компания АстраЗенека. Однако с 2000 года было мало новостей о его прогрессе. Некоторые источники указывают, что его разработка была прекращена.[33][34]
Смена рук
Ремасемид был одним из последних препаратов, разрабатываемых ныне несуществующей английской фармацевтической компанией. Fisons.[35] В 1995 году он был приобретен вместе с большинством Fisons. исследования и разработки операции шведской фармацевтической компании Астра,[36] которая в 1999 году объединилась с британской компанией Зенека формировать АстраЗенека.[37] В 2000 году AstraZeneca рассматривала возможность лицензирования ремасемида какой-то другой фармацевтической компании.[38] но с тех пор новостей о ремасемиде было мало. Разработка Ремасемида могла быть прекращена в июле 2001 года.[34]
Открытие и развитие под Fisons
В 1990 году исследователи из Fisons обнаружили, что ремасемид действует как противосудорожное средство у мышей и крыс[18][28] .[39] Из-за потенциала ремасемида как нейропротекторный агент путем предотвращения глутаматная токсичность, вскоре это было также рассмотрено как лечение за болезнь Хантингтона[40] и болезнь Паркинсона.[41]
Астра
К 1995 году, когда Астра приобрел ремасемид, он уже был в Фаза IIb клиническая разработка как противоэпилептический препарат[36] и Фаза I клиническая разработка в качестве лечения Хантингтона.[40][42]
АстраЗенека
К 1998 году, когда Astra объявила о слиянии с Зенека Ремасемид прогрессировал до Фаза III испытания эпилепсии и Фаза II исследования болезни Паркинсона, и Astra также изучала его потенциал для лечения невропатическая боль[43]
В 1999 году, после слияния, AstraZeneca сообщила, что исследует ремасемид для своей нейропротекторный эффекты, и что они запланировали регулирующие представления для болезнь Хантингтона в 2001 г. и для болезнь Паркинсона и эпилепсия в 2003 г.[44]
Ремасемид под торговым названием Ecovia был обозначен как орфанный препарат для лечения болезнь Хантингтона посредством FDA в марте 2000 г.[1]
Ремасемид последний раз упоминался в АстраЗенека отчеты о своих НИОКР трубопровод в 2000 году, когда он был в Фаза III клинические испытания Ремасемид в лечении болезнь Хантингтона и Фаза II для лечения болезнь Паркинсона. В то время представление Заявка на новое лекарство (NDA) к FDA и Заявление на получение разрешения на маркетинг к CHMP был спроектирован для Хантингтона в 2001 году и для Паркинсона после 2003 года,[38] но новостей о таком представлении не поступало. В этом отчете также отмечалось, что ремасемид «находится на стадии стратегического обзора и является потенциальным кандидатом на лицензирование деятельности».[38] (видеть это внешняя статья о препарате лицензирование.)
Текущие новости
По данным Huntington Study Group, клинические испытания ремасемида не проводятся.[45] и группа изучения болезни Паркинсона.[46]
Доступность
Ремасемид - это экспериментальный препарат недоступен для общественности и в настоящее время не проходит клинические испытания. Он доступен для исследовательских целей Tocris Bioscience по лицензии от АстраЗенека.[47]
Смотрите также
Рекомендации
- ^ а б FDA (05.05.2009). «Сводный список всех продуктов, получивших статус" сирот "» (документ Excel). FDA. Получено 28 апреля 2012.
- ^ Santangeli S, Sills GJ, Thompson GG, Brodie MJ (март 2002 г.). «Эффекты Na (+) канала ремасемида и дезглицинил-ремасемида в кортикальных синаптосомах крыс». Европейский журнал фармакологии. 438 (1–2): 63–8. Дои:10.1016 / S0014-2999 (02) 01297-9. PMID 11906711.
- ^ Мьюир К.В., Лис К.Р. (сентябрь 1995 г.). «Первоначальный опыт применения ремасемида гидрохлорида у пациентов с острым ишемическим инсультом». Летопись Нью-Йоркской академии наук. 765 (1 Neuroprotecti): 322–3. Bibcode:1995НЯСА.765..322М. Дои:10.1111 / j.1749-6632.1995.tb16602.x. PMID 7486631.
- ^ Дайкер А.Г., Лис К.Р. (сентябрь 1999 г.). «Ремасемида гидрохлорид: двойное слепое плацебо-контролируемое исследование безопасности и переносимости у пациентов с острым ишемическим инсультом». Гладить. 30 (9): 1796–801. Дои:10.1161 / 01.STR.30.9.1796. PMID 10471426.
- ^ Веснес К.А., Эдгар С., Дин А.Д., Вроу С.Дж. (март 2009 г.). «Когнитивные и психомоторные эффекты ремасемида и карбамазепина при впервые диагностированной эпилепсии». Эпилепсия и поведение. 14 (3): 522–8. Дои:10.1016 / j.yebeh.2008.11.012. PMID 19111629.
- ^ а б Leach JP, Marson AG, Hutton JL (2002). «Ремасемид для лечения эпилепсии, связанной с лекарственно-устойчивой локализацией». Кокрановская база данных систематических обзоров (4): CD001900. Дои:10.1002 / 14651858.CD001900. PMID 12519561.
- ^ а б c d е ж грамм час я j k л м п Палмер Г.К., Мюррей Р.Дж., Уилсон Т.К., Эйсман М.С., Рэй Р.К., Гриффит Р.К. и др. (Июнь 1992 г.). «Биологический профиль метаболитов и потенциальных метаболитов противосудорожного ремасемида». Исследования эпилепсии. 12 (1): 9–20. Дои:10.1016/0920-1211(92)90086-9. PMID 1388119.
- ^ а б «Многоцентровое рандомизированное контролируемое исследование ремасемида гидрохлорида в качестве монотерапии БП. Исследовательская группа Паркинсона». Неврология. 54 (8): 1583–8. Апрель 2000 г. Дои:10.1212 / wnl.54.8.1583. PMID 10762497.
- ^ Локтон Дж., Коул Дж., Хаммерсли М., Веснес К. (1998). «Ремасемид в терапевтических разовых дозах не влияет на когнитивные функции». J Psychopharmacol. 12 (A41).
- ^ Локтон Дж. А., Веснес К. А., Йейтс Н., Ролан П., Диггори Дж. (1998). «Ремасемид не влияет на когнитивные функции после многократного приема». J Psychopharmacol. 12 (A41).
- ^ Веснес К.А., Эдгар С., Дин А.Д., Вроу С.Дж. (март 2009 г.). «Когнитивные и психомоторные эффекты ремасемида и карбамазепина при впервые диагностированной эпилепсии». Эпилепсия и поведение. 14 (3): 522–8. Дои:10.1016 / j.yebeh.2008.11.012. PMID 19111629.
- ^ Рамакерс Дж., Ламерс Дж., Верхей Ф., Мунтьеверфф Д., Моббс Э., Сандерс Н. и др. (Январь 2002 г.). «Сравнительное исследование эффектов карбамазепина и ремасемида, антагониста рецепторов NMDA, на отслеживание дороги и характеристики автомобиля в реальном движении». Психофармакология. 159 (2): 203–10. Дои:10.1007 / s002130100898. PMID 11862350.
- ^ Райт Л.К., Пирсон Е.К., Хаммонд Т.Г., Пол М.Г. (май – июнь 2007 г.). «Поведенческие эффекты, связанные с хроническим воздействием кетамина или ремасемида у крыс». Нейротоксикология и тератология. 29 (3): 348–59. Дои:10.1016 / j.ntt.2006.12.004. PMID 17291718.
- ^ Попке Э.Дж., Аллен Р.Р., Пирсон Э.С., Хаммонд Т.Г., Пол М.Г. (1 июля 2001 г.). «Дифференциальные эффекты двух антагонистов рецепторов NMDA на когнитивно-поведенческое развитие у нечеловеческих приматов I». Нейротоксикология и тератология. 23 (4): 319–32. Дои:10.1016 / S0892-0362 (01) 00156-8. PMID 11485835.
- ^ Попке Э.Дж., Аллен Р.Р., Пирсон Э.С., Хаммонд Т.Г., Пол М.Г. (1 июля 2001 г.). «Дифференциальные эффекты двух антагонистов рецепторов NMDA на когнитивно-поведенческие характеристики у молодых нечеловеческих приматов II». Нейротоксикология и тератология. 23 (4): 333–47. Дои:10.1016 / S0892-0362 (01) 00138-6. PMID 11485836.
- ^ Попке Э.Дж., Паттон Р., Ньюпорт Г.Д., Рашинг Л.Г., Фогл С.М., Аллен Р.Р. и др. (1 марта 2002 г.). «Оценка потенциальной токсичности МК-801 и ремасемида: хроническое воздействие на молодых макак-резусов». Нейротоксикология и тератология. 24 (2): 193–207. Дои:10.1016 / S0892-0362 (02) 00206-4. PMID 11943507.
- ^ Пол М.Г., Фогл С.М., Аллен Р.Р., Пирсон Э.С., Хаммонд Т.Г., Попке Э.Д. (май 2003 г.). «Хроническое воздействие NMDA-рецепторов и блокаторов натриевых каналов во время развития у обезьян и крыс: долгосрочное влияние на когнитивные функции». Летопись Нью-Йоркской академии наук. 993 (1): 116–22, обсуждение 123-4. Дои:10.1111 / j.1749-6632.2003.tb07519.x. PMID 12853303.
- ^ а б c d е Stagnitto ML, Palmer GC, Ordy JM, Griffith RC, Napier JJ, Becker CN и др. (Сентябрь – октябрь 1990 г.). «Доклинический профиль ремасемида: новый противосудорожный препарат, эффективный против максимальных приступов электрошока у мышей». Исследования эпилепсии. 7 (1): 11–28. Дои:10.1016/0920-1211(90)90050-6. PMID 1963406.
- ^ «Влияние ремасемида гидрохлорида на концентрацию леводопы при болезни Паркинсона. Исследовательская группа Паркинсона». Клиническая нейрофармакология. 22 (4): 220–5. Июль – август 1999 г. PMID 10442252.
- ^ Лич Дж. П., Гирван Дж., Джеймисон В., Джонс Т., Риченс А., Броди М. Дж. (Июнь 1997 г.). «Отсутствие фармакокинетического взаимодействия между гидрохлоридом ремасемида и вальпроатом натрия у больных эпилепсией». Захват. 6 (3): 179–84. Дои:10.1016 / S1059-1311 (97) 80003-9. PMID 9203245.
- ^ Лич Дж. П., Блэкло Дж., Джеймисон В., Джонс Т., Риченс А., Броди М. Дж. (Ноябрь 1996 г.). «Взаимодействие между гидрохлоридом ремасемида и карбамазепином: два препарата с активными метаболитами». Эпилепсия. 37 (11): 1100–6. Дои:10.1111 / j.1528-1157.1996.tb01031.x. PMID 8917061.
- ^ Льюис Г. Р., Стил Дж., Макбрайд Л., Флоренс А. Дж., Кеннеди А. Р., Шенкленд Н. и др. (1 марта 2005 г.). «Гидрофобные против гидрофильных: ионная конкуренция в структурах солей ремасемида». Рост кристаллов и дизайн. 5 (2): 427–438. Дои:10.1021 / cg049836u.
- ^ Субраманиам С., Доневан С.Д., Рогавски М.А. (январь 1996 г.). «Блокировка рецептора N-метил-D-аспартата ремасемидом и его метаболитом дез-глицина». Журнал фармакологии и экспериментальной терапии. 276 (1): 161–8. PMID 8558426.
- ^ а б Хейн Х., Маккарти ди-джей, Карри С.Х., Эйсман М.С., Андерс М.В. (май – июнь 1994 г.). «Захват мозга и биотрансформация ремасемида гидрохлорида, нового противосудорожного средства». Метаболизм и утилизация лекарств. 22 (3): 443–6. PMID 8070322.
- ^ ван Луйтелаар Э.Л., Коенен А.М. (апрель 1995 г.). «Влияние ремасемида и его метаболита FPL 12495 на спайк-волновые разряды, электроэнцефалограмму и поведение крыс с абсансной эпилепсией». Нейрофармакология. 34 (4): 419–25. Дои:10.1016 / 0028-3908 (95) 00008-Т. HDL:2066/28626. PMID 7566473.
- ^ Хардебо Дж. Э., Нильссон Б. (октябрь 1979 г.). «Оценка мозгового извлечения циркулирующих соединений методом индекса поглощения головным мозгом: влияние времени циркуляции, объема инъекции и церебрального кровотока». Acta Physiologica Scandinavica. 107 (2): 153–9. Дои:10.1111 / j.1748-1716.1979.tb06455.x. PMID 525379.
- ^ Oldendorf WH, Pardridge WM, Braun LD, Crane PD (май 1982 г.). «Измерение утилизации церебральной глюкозы с использованием вымывания после инъекции сонной артерии у крысы». Журнал нейрохимии. 38 (5): 1413–8. Дои:10.1111 / j.1471-4159.1982.tb07920.x. PMID 7062059.
- ^ а б Гарске Г.Е., Палмер Г.К., Напье Дж.Дж., Гриффит Р.С., Фридман Л.Р., Харрис Э.В. и др. (Сентябрь 1991 г.). «Доклинический профиль противосудорожного ремасемида и его энантиомеров у крыс». Исследования эпилепсии. 9 (3): 161–74. Дои:10.1016 / 0920-1211 (91) 90050-п. PMID 1660399.
- ^ Ху Р. К., Дэвис Дж. А. (декабрь 1995 г.). «Влияние дезглицинилового метаболита ремасемида на корковые клинья, полученные от мышей DBA / 2». Европейский журнал фармакологии. 287 (3): 251–6. Дои:10.1016/0014-2999(95)00500-5. PMID 8991798.
- ^ Норрис С.К., король А.Е. (июль 1997 г.). «Электрофизиологические эффекты противосудорожного ремацемида гидрохлорида и его метаболита ARL 12495AA на нейроны гиппокампа CA1 крысы in vitro». Нейрофармакология. 36 (7): 951–9. Дои:10.1016 / S0028-3908 (97) 00069-5. PMID 9257939.
- ^ Leach JP, Sills GJ, Butler E, Forrest G, Thompson GG, Brodie MJ (июль 1997 г.). «Нейрохимическое действие дезглицинилового метаболита ремасемида гидрохлорида (ARL 12495AA) на мозг мышей». Британский журнал фармакологии. 121 (5): 923–6. Дои:10.1038 / sj.bjp.0701219. ЧВК 1564774. PMID 9222548.
- ^ Норрис С.К., король А.Е. (июнь 1997 г.). «Стерео-изомеры противосудорожного средства ARL 12495AA ограничивают устойчивое повторяющееся возбуждение и изменяют свойства потенциала действия нейронов гиппокампа крысы in vitro». Журнал фармакологии и экспериментальной терапии. 281 (3): 1191–8. PMID 9190853.
- ^ "remacemide () База данных новых лекарств UKMi в Интернете". Получено 2 мая 2012.
- ^ а б "Ремасемид АстраЗенека прекращен, Европа, США, Канада (эпилепсия)". Новости исследований и разработок Focus Drug News. 15 марта 2004 г. Архивировано с оригинал 18 мая 2013 г.. Получено 2 мая 2012.
- ^ "FISONS ПРЕКРАЩАЕТ ТИПРЕДАН DEV'T". фармацевтическое письмо. 12 апреля 1993 г.. Получено 28 апреля 2012.
- ^ а б «Шведская Astra покупает большую часть научно-исследовательских и опытно-конструкторских работ Fisons». фармацевтическое письмо. 27 марта 1995 г.. Получено 28 апреля 2012.
- ^ «История АстраЗенека». АстраЗенека. Получено 29 апреля 2012.
- ^ а б c «АстраЗенека НИОКР: НПП». AstraZeneca. 2000 г.. Получено 28 апреля 2012.
- ^ Палмер Г.К., Харрис Е.В., Напье Дж.Дж., Стагнитто М.Л., Гарске Г.Е., Гриффит Р.С., Свиньярд Е.А. (1990). «Статус PR 934-423, нового противосудорожного средства, предназначенного для генерализованных тонических / клонических приступов (новое обозначение - FPL 12924AA)». Прогресс в клинических и биологических исследованиях. 361: 435–41. PMID 2290849.
- ^ а б Кибурц К., Фейгин А., Макдермотт М., Комо П., Абвендер Д., Циммерман С. и др. (Май 1996 г.). «Контролируемое испытание ремасемида гидрохлорида при болезни Хантингтона». Двигательные расстройства. 11 (3): 273–7. Дои:10.1002 / mds.870110310. PMID 8723144.
- ^ Гринамир Дж. Т., Эллер Р. В., Чжан З., Овадия А., Курлан Р., Гаш Д. М. (июнь 1994 г.). «Противопаркинсонические эффекты ремасемида гидрохлорида, антагониста глутамата, на моделях болезни Паркинсона на грызунах и приматах». Анналы неврологии. 35 (6): 655–61. Дои:10.1002 / ana.410350605. PMID 8210221.
- ^ «Завершенные клинические испытания». Группа изучения Хантингтона. 2010. Архивировано с оригинал 28 июня 2012 г.. Получено 29 апреля 2012.
- ^ «Годовой отчет Астра 98» (PDF). Stellan Ståls Grafiska AB. Получено 28 апреля 2012.
- ^ Полинский Р. «АстраЗенека ЦНС». АстраЗенека. Получено 27 апреля 2012.
- ^ «Продолжаются клинические испытания и обсервационные исследования». Исследовательская группа Хантингтона. 2010. Архивировано с оригинал 18 мая 2009 г.. Получено 29 апреля 2012.
- ^ «Клинические испытания в процессе - группа по изучению болезни Паркинсона». Архивировано из оригинал 11 сентября 2011 г.. Получено 2 мая 2012.
- ^ "Ремасемида гидрохлорид кат. № 1622". Токрис. Получено 29 апреля 2012.
