Фармакодинамика прогестерона - Pharmacodynamics of progesterone
В фармакология из прогестерон, а прогестаген лекарства и встречающиеся в природе стероидный гормон, касается его фармакодинамика, фармакокинетика, и различные пути введения.[1][2]
Прогестерон - это встречающиеся в природе и биоидентичный прогестаген, или агонист из рецептор прогестерона, то биологическая мишень из прогестагены любить эндогенный прогестерон.[3] Прогестерон также имеет антиминералокортикоид и тормозящий нейростероид активности, в то время как у него, похоже, мало или нет глюкокортикоид или антиандрогенный активности и не имеет андрогенный Мероприятия.[3] Прогестерон обладает прогестагенной активностью. антиэстрогенный эффекты в некоторых ткани такой как матка, шейка матки, и влагалище.[3] Кроме того, прогестерон имеет антигонадотропный эффекты из-за его прогестагенной активности и могут подавлять плодородие и подавить половой гормон производство.[3] Прогестерон отличается от прогестины (синтетический прогестагены ) любить медроксипрогестерона ацетат и норэтистерон, с последствиями для фармакодинамика и фармакокинетика а также эффективность, переносимость, и безопасность.[3]
Прогестерон можно принимать устно, через влагалище, и по инъекция в мышца или жир, среди других маршрутов.[3] А прогестерон вагинальное кольцо и прогестерон внутриматочная спираль также доступны в виде фармацевтических продуктов.[4][5]
Механизм действия
Прогестерон - это прогестаген, или агонист из ядерный рецепторы прогестерона (PR), PR-A, PR-B, и PR-C.[3] В одном исследовании прогестерон показал: ЕС50 значения 7,7 нМ для человеческого PR-A и 8,0 нМ для человеческого PR-B.[6] Помимо PR, прогестерон является агонистом мембранные рецепторы прогестерона (mPR), включая mPRα, mPRβ, mPRγ, mPRδ, и mPRϵ.[7][8] Это также мощный антиминералокортикоид (антагонист из минералокортикоидный рецептор (Г-Н)),[9][10] а также очень слабый глюкокортикоид (агонист рецептор глюкокортикоидов ).[11][12] Прогестерон существенно не взаимодействует с рецептор андрогенов (AR) или с рецептор эстрогена (ER).[3] Прогестерон не только стероидный гормон, но и нейростероид.[13] В частности, это антагонист сигма σ1 рецептор,[14][15] а отрицательный аллостерический модулятор из никотиновые рецепторы ацетилхолина,[13] и через его активные метаболиты аллопрегнанолон и прегнанолон, мощный положительный аллостерический модулятор из ГАМКА рецептор, главный сигнальный рецептор тормозящий нейротрансмиттер γ-аминомасляная кислота (ГАМК).[16]
| Соединение | PR | AR | ER | GR | Г-Н | SHBG | CBG |
|---|---|---|---|---|---|---|---|
| Прогестерон | 50 | 0 | 0 | 10 | 100 | 0 | 36 |
| Заметки: Значения указаны в процентах (%). Справка лиганды (100%) были промегестон для PR, метриболон для AR, E2 для ER, DEXA для GR, альдостерон для Г-Н, DHT для SHBG, и кортизол для CBG. Источники: [3] | |||||||
| Соединение | Форма | Доза для конкретного использования (мг)[c] | DOA[d] | |||
|---|---|---|---|---|---|---|
| TFD[e] | POICD[f] | CICD[г] | ||||
| Алгестон ацетофенид | Масло солн. | - | – | 75–150 | 14–32 дней | |
| Гестонорон капроат | Масло солн. | 25–50 | – | – | 8–13 дней | |
| Гидроксипрогест. ацетат[час] | Aq. Susp. | 350 | – | – | 9–16 дней | |
| Гидроксипрогест. капроат | Масло солн. | 250–500[я] | – | 250–500 | 5–21 дн. | |
| Medroxyprog. ацетат | Aq. Susp. | 50–100 | 150 | 25 | 14–50 + д | |
| Мегестрола ацетат | Aq. Susp. | - | – | 25 | > 14 дней | |
| Норэтистерона энантат | Масло солн. | 100–200 | 200 | 50 | 11–52 дня | |
| Прогестерон | Масло солн. | 200[я] | – | – | 2–6 дней | |
| Aq. soln. | ? | – | – | 1–2 дня | ||
| Aq. Susp. | 50–200 | – | – | 7–14 дней | ||
Примечания и источники:
| ||||||
Антиминералокортикоидная активность
Прогестерон - мощный антиминералокортикоид.[9][10][37] Имеет 1000% сродства альдостерон, Основным эндогенный агонист для MR человека и 100% сродство альдостерона к MR крысы.[38][3][9] Прогестерон оказывает антиминералокортикоидное действие, например: натрийурез (выделение из натрий в моча ) при нормальных физиологических концентрациях.[10] Считается, что доза прогестерона орально 200 мг приблизительно эквивалентна по антиминералокортикоидному эффекту дозе 25-50 мг сильнодействующего антиминералокортикоида. спиронолактон, который сам по себе является производным прогестерона.[39] Дозы прогестерона от 50 до 200 мг по внутримышечная инъекция, которые похожи на воздействие прогестерона в третий триместр из беременность, также сообщалось, что они вызывают антиминералокортикоидные эффекты.[37] Антиминералокортикоидные эффекты прогестерона лежат в основе его способности пониженное кровяное давление и уменьшить воды и задержка соли и его потенциальное применение при лечении гипертония.[40][3][41][37] An активный метаболит прогестерона, 11-дезоксикортикостерон (21-гидроксипрогестерон), представляет собой предшественник альдостерона и имеет сильный минералокортикоид активности (т.е. является сильным агонистом МР).[39] Однако он образуется в относительно небольших количествах, и любые подобные эффекты, вызываемые им, обычно перевешиваются антиминералокортикоидной активностью прогестерона.[39]
Глюкокортикоидная активность
Прогестерон - это частичный агонист из рецептор глюкокортикоидов (GR).[3][11][12][42][43] Он имеет около 35% сродства дексаметазон, а кортикостероид для человеческого GR и примерно от 3 до 11% сродства дексаметазона к крысиному GR.[38] Однако прогестерон, по-видимому, проявляет слабую глюкокортикоидную активность или ее отсутствие и антиглюкокортикоид Мероприятия in vitro и у животных.[43] Тем не менее было обнаружено, что прогестерон активирует рецептор тромбина в гладкомышечные клетки сосудов in vitro, глюкокортикоидный эффект, и это может иметь клиническое значение в отношении риска образования тромбов.[3][44]
| Стероидный препарат | Класс | TR (↑ )а | GR (%)б |
|---|---|---|---|
| Дексаметазон | Кортикостероид | ++ | 100 |
| Этинилэстрадиол | Эстроген | – | 0 |
| Этоногестрел | Прогестин | + | 14 |
| Гестоден | Прогестин | + | 27 |
| Левоноргестрел | Прогестин | – | 1 |
| Медроксипрогестерона ацетат | Прогестин | + | 29 |
| Норэтистерон | Прогестин | – | 0 |
| Norgestimate | Прогестин | – | 1 |
| Прогестерон | Прогестаген | + | 10 |
| Сноски: а = Рецептор тромбина (TR) усиление регулирования (↑) в гладкомышечные клетки сосудов (VSMC). б = РБА (%) для рецептор глюкокортикоидов (GR). Прочность: - = Нет эффекта. + = Ярко выраженный эффект. ++ = Сильный эффект. Источники: [3] | |||
Андрогенная и антиандрогенная активность
Связывание и активность прогестерона в AR, биологическая мишень из андрогены любить тестостерон и дигидротестостерон (ДГТ) в организме, является спорным.[45] Некоторые исследования показали, что прогестерон связывается с AR, проявляя агонистическую и антагонистическую активность, тогда как другие исследования показали очень низкое сродство к AR или его полное отсутствие.[45] В исследованиях на животных нет андрогенный эффекты наблюдались, но слабые антиандрогенный не поступало сообщений об эффектах.[45] Слабую антиандрогенную активность приписывают не антагонизму AR прогестероном, а его слабой 5α-редуктаза ингибирование и последующее подавление превращения тестостерона в более мощный DHT.[45] Клинических данных об АР-опосредованной андрогенной или антиандрогенной активности прогестерона нет.[45] Прогестерон не был связан с какими-либо классическими андрогенными эффектами в клинических исследованиях у женщин, включая отсутствие изменений в липид крови профиль или глобулин, связывающий половые гормоны уровни акне, жирная кожа, гирсутизм, или голос становится громче, ни с вирилизация плодов женского пола.[46][47][48][49][50] Таким образом, научный консенсус состоит в том, что прогестерон клинически не является ни андрогенным, ни антиандрогенным.[3][51][52] Это контрастирует со многими прогестинами, такими как 19-нортестостерон производные (например, норэтистерон, левоноргестрел, диеногест ) и 17α-гидроксипрогестерон производные (например, ципротерона ацетат, медроксипрогестерона ацетат ), которые связываются с АР и связаны со значительными андрогенными или антиандрогенными эффектами в зависимости от рассматриваемого прогестина.[3][52] Из-за отсутствия андрогенной и антиандрогенной активности и, следовательно, отсутствия маскулинизирующий и феминизирующий эффекты, прогестерон - один из немногих прогестагенов, который подходит для использования во время беременность у женщин из группы риска преждевременные роды или повторный выкидыш.[53][54]
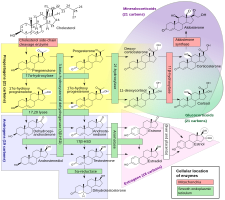
Хотя прогестерон не обладает значительной AR-опосредованной андрогенной или антиандрогенной активностью, это предшественник и средний хоть и далекий, но в биосинтез андрогенов из холестерин.[55][56] По этой причине высказывались предположения, что экзогенный прогестерон может быть преобразованный в андрогены определенными ткани которые экспрессируют необходимые ферменты.[56][57] Прогестерон преобразуется 17α-гидроксилаза в 17α-гидроксипрогестерон; 17α-гидроксипрогестерон превращается 17,20-лиаза в андростендион; и андростендион превращается 17β-гидроксистероид дегидрогеназы в тестостерон.[55] CYP17A1, то цитохром P450 ген кодирует 17α-гидроксилазу и 17,20-лиазу, экспрессируется в основном в гонады (яичники и яички ) и надпочечники.[58] Однако, хотя теоретически возможно, что прогестерон может быть преобразован в организме в андрогены, в исследованиях на животных не наблюдалось андрогенных эффектов.[45] Кроме того, клинические исследования, в которых женщины получали прогестерон перорально от 100 до 300 мг / день, не обнаружили или обнаружили лишь небольшое повышение уровней 17α-гидроксипрогестерона и никаких изменений в уровнях андрогенов, включая дегидроэпиандростерон, андростендион и тестостерон.[50][59][46] В этих исследованиях уровни эстрадиол и кортизол, предшественником которого также является прогестерон, также не изменилось, хотя уровни 11-дезоксикортикостерона значительно увеличились.[59][46]
Ингибирование 5α-редуктазы
Прогестерон - это субстрат для 5α-редуктаза, и было обнаружено, что он действует как конкурентный ингибитор этого фермент in vitro в различных исследованиях.[3] В одном исследовании было показано IC50 значения 1375 нМ и 88 нМ (в присутствии 50 нМ андростендион как субстрат ) для типов 5α-редуктазы 1 и 2 соответственно.[60] 5α-редуктаза сильно экспрессируется в кожа, Волосяные луковицы, и простата, и отвечает за преобразование тестостерона в несколько более мощный андрогенный ДГТ в таких тканях.[61][62] Таким образом, было высказано предположение, что прогестерон может обладать некоторым антиандрогенным действием, действуя как Ингибитор 5α-редуктазы.[3] Однако ингибирование 5α-редуктазы прогестероном описывается как слабый эффект, который был только продемонстрирован. in vitro и в супрафизиологических концентрациях.[63][64] Соответственно, не было обнаружено, что физиологические уровни циркулирующего прогестерона существенно влияют на концентрацию циркулирующего ДГТ.[65][66]
Врожденный дефицит 5α-редуктазы 2 редкий условие интерсекса что связано с неоднозначные гениталии в мужском плоды из-за нехватки ДГТ во время генитальный дифференциация.[62] Экспериментальное пренатальное воздействие установленных ингибиторов 5α-редуктазы, таких как финастерид было обнаружено, что он вызывает аналогичные феминизированные дефекты половых органов у самцов животных, включая грызунов и обезьян.[67] Напротив, экзогенное введение прогестерона беременным грызунам и обезьянам привело к минимальным отклонениям от нормы как у самцов, так и у самок.[68][69][70][71] Кроме того, уровень эндогенного прогестерона естественным образом повышается до чрезвычайно высоких концентраций во время беременности, но дефектов половых органов не возникает.[72] Соответственно, в то время как общие концентрации прогестерона у доношенных беременных составляют около 150 нг / мл (~ 500 нМ), свободные или несвязанные и, следовательно, биоактивные концентрации прогестерона составляют всего около 3 нг / мл (~ 10 нМ) из-за высокой связывание с белками плазмы прогестерона, и эти концентрации по-прежнему значительно ниже вышеупомянутых IC50 значения для ингибирования 5α-редуктазы типов 1 и 2.[73][74] Как и в случае эндогенного прогестерона во время беременности, экзогенный дополнительный прогестерон во время беременности не увеличивает риск гипоспадия у младенцев мужского пола.[75]
Хотя системный прогестерон, по-видимому, не является эффективным ингибитором 5α-редуктазы, местный прогестерон может вызывать сильное ингибирование 5α-редуктазы в коже из-за очень высоких местных концентраций.[76][77] Исследование показало, что местное нанесение прогестерона на лобковую область у мужчин ингибирует 5α-редуктазу в коже в этой области на 75%.[77][78] В дополнение к ингибированию 5α-редуктазы прогестерон метаболизируется 5α-редуктазой в 5α-дигидропрогестерон (5α-DHP), соединение, которое, как сообщается, имеет некоторые антагонистический активность в АР.[78][79] Однако это соединение не обладает системной антиандрогенной активностью.[80] Несмотря на очевидное ингибирование 5α-редуктазы, эффективность местного прогестерона в лечении узор облысения был плохим.[79][81][82]
Другая деятельность
Было обнаружено, что некоторые прогестины стимулируют распространение из MCF-7 рак молочной железы клетки in vitro, действие, которое не зависит от классических PR и вместо этого опосредуется через компонент мембраны рецептора прогестерона-1 (PGRMC1).[83] Прогестерон, номегестрола ацетат, и хлормадинона ацетат действуют нейтрально и не стимулируют распространение, тогда как норэтистерон, дезогестрел, левоноргестрел, и дроспиренон сильно стимулируют распространение и медроксипрогестерона ацетат, диеногест, и дидрогестерон слабо стимулируют распространение.[83][84] Таким образом, прогестерон отличается от некоторых, но не от всех прогестинов активностью, опосредующей этот PGRMC1-зависимый эффект.[83] Неясно, могут ли эти результаты объяснить различные риски рака груди, наблюдаемые при приеме прогестерона, дидрогестерона и других прогестинов, таких как медроксипрогестерона ацетат и норэтистерон. клинические исследования.[85]
Воздействие на тело и мозг
PR широко выражены по всему телу, в том числе в матка, шейка матки, влагалище, фаллопиевы трубы, грудь, жир, кожа, гипофиз, гипоталамус, и в других местах мозг.[3][86] Через активацию PR (а также mPR) прогестерон оказывает множество эффектов, включая следующие:[3][86]
- Вызывает секреторная трансформация эндометрия в рамках подготовки к беременность (> 5 нг / мл)[87]
- Предотвращает вызванное эстрогеном гиперплазия эндометрия и увеличился рак эндометрия рисковать
- Поддерживает беременность за счет воздействия на эндометрий (абстиненция приводит к выкидыш )
- Уменьшает количество и фиброзность из цервикальная слизь и заставляет шейку матки становиться более твердой и плотно закрытой[88]
- Контролирует подвижность и состав жидкости в фаллопиевы трубы
- Уменьшенный ороговение и созревание слизистой оболочки влагалища[89]
- Причины задержка воды в груди, что приводит к временному увеличение в течение менструальный цикл[90][91]
- Посредники лобулоальвеолярное развитие груди, необходимой для лактация
- Подавляет начало лактации и запускает лактацию при отмене (как с роды )
- Поддерживает здоровье, целостность, внешний вид и увлажнение кожи и замедляет старение кожи.[92][93]
- Модулирует работу мозга, влияя на настроение, эмоциональность, и сексуальность, а также познание и объем памяти
- Оказывает негативный отзыв на гипоталамо-гипофизарно-гонадная ось (Ось HPG) путем подавления секреции гонадотропинов ФСГ и ЛГ из гипофиза (включая выброс гонадотропинов в середине цикла), тем самым подавляя гонадный половой гормон производство, а также овуляция и плодородие (> 2 нг / мл)[94]
- Увеличивает базальная температура тела (на 0,3–0,6 ° C (0,5–1,0 ° F) относительно преовуляция ) через гипоталамус (> 4 нг / мл)[95][96]
- Уменьшает приливы через гипоталамус[97][98]
- Стимулирует дыхание через гипоталамус и / или дыхательный центр[99][100]
- Влияет на риск и / или прогрессирование гормоночувствительного рака, включая рак груди и рак эндометрия.
Многие эффекты прогестерона требуют эстрогена, поскольку эстрогены стимулируют ткани для прогестерона, индуцируя экспрессию PR.[3][86] PR индуцируются в груди эстрогенами, и по этой причине предполагается, что прогестагены не могут опосредовать изменения груди в отсутствие эстрогенов.[101]
Прогестерон также снижает кровяное давление и уменьшает воды и задержка соли среди других эффектов через его антиминералокортикоидную активность.[3][41]
Прогестерон может производить успокаивающее, гипнотический, анксиолитик, эйфорический, когнитивный, объем памяти-, и двигательный, противосудорожное средство, и даже анестетик эффекты за счет образования достаточно высоких концентраций его метаболитов нейростероидов и, как следствие, ГАМКА потенцирование рецепторов в головном мозге.[40][102][103][104]
Маточные эффекты
В нормальных физиологических условиях прогестерон секретируется желтое тело в течение лютеиновой фазы из менструальный цикл производит трансформация эндометрия эстрогеновых матка в рамках подготовки к имплантация и беременность.[105] Нормальная выработка прогестерона во время лютеиновой фазы составляет в среднем 25 мг / день с диапазоном от 15 до 50 мг / день.[106][71] Уровни прогестерона во время лютеиновой фазы колеблются от 7 нг / мл до 22 нг / мл при использовании жидкостная хроматография – тандемная масс-спектрометрия (ЖХ – МС / МС) на один источник.[107] Для полной трансформации эндометрия необходимы стабильные уровни прогестерона более 5 нг / мл.[87] Уровни прогестерона более 10 нг / мл редко связаны с лютеиновый дефект на основе биопсия эндометрия.[108]
Считается, что уровни прогестерона в лютеиновой фазе продуцируются 25 мг / день прогестероном в масляном растворе внутримышечной инъекцией или 100 мг / день прогестероном вагинальным или ректальным введением.[71][109] Было обнаружено, что прогестерон при внутримышечной инъекции в масляном растворе вызывает трансформацию эндометрия в дозе 10 или 20 мг / день в течение 14 дней (общая доза за цикл составляет 200 мг), тогда как однократная внутримышечная инъекция прогестерона 200 мг в микрокристаллической водной суспензии обеспечивает трансформацию эндометрия через 10-14 дней.[110] Исследование показало полную и эквивалентную трансформацию эндометрия с подкожная инъекция 25 мг / день по сравнению с 50 мг / день прогестерона в водный раствор.[111] Из-за маточного эффект первого прохода и заметно более высокие уровни прогестерона в матке, чем при других способах введения, 45 мг / день вагинального прогестерона, дозировка, которая позволяет достичь уровня циркулирующего прогестерона только от 1 до 5 нг / мл, обеспечивает полную трансформацию эндометрия.[112][109] Наоборот, интраназальное введение достижения прогестерона уровня прогестерона от 2 до 5 нг / мл было неэффективным.[112] Трансдермальный прогестерон обеспечивает очень низкий уровень прогестерона и считается неэффективным для защиты эндометрия.[112][113][114]
Дозировка микронизированного прогестерона для женщин при трансформации эндометрия составляет от 200 до 300 мг / день или 4200 мг за цикл.[115][3] Однако клиническое исследование показало, что микронизированный прогестерон в дозе 300 мг / день для перорального приема был недостаточен для полной трансформации эндометрия.[116] Аналогичным образом сообщалось, что пероральный прием микронизированного прогестерона от 600 до 1000 мг / день неэффективен для достижения полной трансформации эндометрия.[112][111] Несмотря на неадекватную трансформацию эндометрия при пероральном приеме прогестерона, непрерывный прием микронизированного прогестерона в дозе 100 мг / день или циклический прием микронизированного прогестерона в дозе 200 мг / день эффективен для защиты эндометрия от индуцированного эстрогеном гиперплазия эндометрия.[117] С другой стороны, в отличие от прогестинов, типичные клинические дозы микронизированного прогестерона для перорального применения были связаны с неспособностью предотвратить увеличение рак эндометрия риск, вызванный терапией эстрогенами.[118]
Антиэстрогенные эффекты
Прогестерон, как и все прогестагены, имеет антиэстрогенный эффекты в некоторых ткани такой как матка, шейка матки, влагалище, и грудь, а также, возможно, мозг.[3][119][120] Эти эффекты опосредуются активацией PR в этих тканях.[3] Прогестерон не оказывает антиэстрогенного действия в более общепринятом смысле этого слова. привязка и противодействие ER или связывание и ингибирование ферменты участвует в эстрогенах биосинтез.[3] Вместо этого, например, в эндометрий, прогестерон вызывает подавление скорой помощи и усиление регулирования ферментов, инактивирующих эстроген 17β-гидроксистероид дегидрогеназа 2 (превращает эстрадиол в эстрон ) и эстронсульфотрансфераза (превращает эстрон в эстрон сульфат ).[3] Антиэстрогенные эффекты прогестерона и других прогестагенов лежат в основе их единственного одобренного показания в гормональной терапии менопаузы: предотвращение долгосрочной гиперплазии эндометрия, вызванной эстрогеном, и повышенного риска рака эндометрия у женщин с интактной маткой.[3]
В груди прогестерон и другие гестагены снижают регуляцию ER, а также ферментов, активирующих эстроген. стероид сульфатаза (превращает сульфат эстрона в эстрон) и 17β-гидроксистероид-дегидрогеназа 1 (превращает эстрон в эстрадиол) и активирует эстрон-сульфотрансферазу.[119][120] Однако другие исследования показывают, что прогестагены не подавляют экспрессию ER в груди.[121] При нанесении непосредственно на грудь у женщин прогестерон может блокировать пролиферативные эффекты эстрадиола.[122][101][123][124][125][126][127][85] Однако концентрации были супрафизиологическими, и то же самое может не относиться к более физиологическим концентрациям.[125][85] Клеточная пролиферация груди наиболее высока в лютеиновой фазы из менструальный цикл, когда уровень прогестерона самый высокий.[85]
Была выдвинута гипотеза, что прогестагены могут противодействовать различным эффектам эстрогенов в мозге, таким как стимулирующий и возбуждающий влияние на нейронная активность.[3] Кроме того, прогестерон занимает особое место среди прогестагенов в отношении таких действий из-за его тормозящий метаболиты нейростероидов и их центральный депрессант эффекты.[3] Было высказано предположение, что эти действия прогестагенов могут объяснить неблагоприятное воздействие на настроение о которых сообщалось с этими лекарствами у некоторых женщин.[3] Однако взаимные взаимодействия эстрогенов и прогестагенов в мозге в целом спорны и требуют дополнительных исследований.[3]
Прогестерон может оказывать антиэстрогенное действие на все тело в очень высоких дозах как у женщин, так и у мужчин за счет своего антигонадотропный эффекты и последующее подавление выработки эстрогена гонадными железами (см. ниже ).[3][128] Эти антигонадотропные эффекты опосредованы гиперактивацией PR.[3][128]
Воздействие на ось HPG
Антигонадотропные эффекты
Прогестагены имеют антигонадотропный эффекты при достаточно высоких дозах через активацию PR и, как следствие, негативный отзыв на и, следовательно, подавление гипоталамо-гипофизарно-гонадная ось (Ось HPG).[128] Это приводит к подавлению гонадотропин секреция и, как следствие, вмешательство в плодородие и гонадный половой гормон производство.[128] Прогестерон предотвращает овуляцию, подавляя всплеск секреции гонадотропина в середине цикла во время менструальный цикл.[129][94]
В овуляция - ингибирующая (т.е. контрацептивная) доза перорального кристаллического (немикронизированного) прогестерона для женщин составляет 300 мг / день или больше.[71][130][3][131][132] Однако эта цифра основана на ограниченных клинических данных.[71] В клинических исследованиях 1950-х годов, которые определяли эту дозировку, ингибирование овуляции происходило у 50-100% женщин при оценке с помощью таких показателей, как мочевой прегнандиол выделение, повседневная базальная температура тела, биопсия эндометрия, и мазки из влагалища.[130][133][134][135][136] Другое исследование показало, что подавление овуляции при пероральном приеме немикронизированного прогестерона в дозе 300 мг / день происходило в «пропорции случаев» при оценке с помощью лапаротомия.[135] Третье исследование показало, что овуляция подавлялась только у 38% женщин, получавших 1000 мг / день немикронизированного прогестерона перорально.[131] В четвертой публикации говорится, что даже от 750 до 1000 мг / день немикронизированного прогестерона при пероральном приеме были слабые эффекты, о чем свидетельствуют плохие результаты. термогенный эффект слабый эндометрий эффект, и отсутствие производства кровотечение отмены в аменорейный женщины.[137][138] Neumann и его коллеги перечислили дозировку немикронизированного прогестерона для женщин, подавляющую овуляцию, от 300 до 500 мг / день, но не предоставили никаких других подробностей.[132][139][140]
При исследовании вагинального кольца прогестерона отдельно или в сочетании с эстрадиолом, которое высвобождает прогестерон от 1,5 до 3 мг / день и достигает средних уровней прогестерона, варьирующихся от 0,7 до 1,6 нг / мл (в среднем 0,9 нг / мл) во время ановуляторных циклов, овуляция произошла в 18 из 30 (60%) менструальных циклов.[141] Исследование вагинального кольца с прогестероном, которое высвобождает прогестерон почти 10 мг / день и поддерживает средний уровень прогестерона 4,4 нг / мл (диапазон 2,4–6,5 нг / мл), показало, что овуляция подавляется у некоторых, но не у всех женщин.[142][143] В другом исследовании вагинальное кольцо с прогестероном, которое выделяло около 10 мг прогестерона в день и вырабатывало уровни прогестерона около 4 нг / мл (диапазон 3–5,2 нг / мл), привело к овуляции, происходящей у 25% кормящих женщин, получавших лечение, по сравнению со скоростью 56% в контрольной группе кормящих женщин.[144] Исследование в макаки резус обнаружили, что вагинальное кольцо, доставляющее прогестерон 0,235 или 1,77 мг / день, подавляло овуляцию у всех обезьян при более высокой дозе и у части обезьян при более низкой дозе.[68][145] Было обнаружено, что доза прогестерона от 5 до 10 мг / день путем внутримышечной инъекции предотвращает овуляцию у женщин и считается эффективной как средство инъекционные контрацептивы, содержащие только прогестагены.[146][25]
Краткосрочная терапия прогестероном внутрь 300 мг / день не оказала влияния на лютеинизирующий гормон частота пульса у женщин.[147] Лечение высокими дозами прогестерона перорально 100 мг четыре раза в день (или всего 400 мг / день) у мужчин в течение 10 дней не вызывало каких-либо изменений. тестостерон Это позволяет предположить, что пероральный прогестерон оказывает незначительное антигонадотропное действие или не оказывает никакого антигонадотропного эффекта у мужчин при типичных клинических дозах.[40][148] Кроме того, исследование показало, что пероральное введение 1000 мг прогестерона в день в течение 3 месяцев не оказало значительного влияния на мочевой гонадотропин выделение.[71] С другой стороны, однократная внутримышечная инъекция 50 мг прогестерона, которая связана с высокими уровнями прогестерона примерно 50 нг / мл (или уровнями на ранних и средних сроках беременности),[149][150][151] привело к существенному (50–60%) подавлению лютеинизирующий гормон, фолликулостимулирующего гормона, и уровень тестостерона у мужчин.[152][153] Точно так же непрерывный или прерывистый внутривенные инъекции прием прогестерона от 100 до 400 мг / день в течение 10 дней значительно снизил экскрецию гонадотропинов с мочой.[71][154] Прогестагены в целом способны подавлять выработку тестостерона гонадными организмами у мужчин максимум примерно на 70-80% или чуть выше. кастрировать уровни при использовании в достаточно высоких дозах.[155][156]
Исследование с использованием 50 мг / сут прогестерона внутримышечно у пяти мужчин показало, что лекарство производит азооспермия или серьезный олигозооспермия всего в течение 10 недель, подавлено либидо, эректильная функция, и эякулят громкость до минимального уровня гинекомастия у двух мужчин умеренно снизился размер яичек, и ослабленные яичко морфология.[25][157][158][153][159][160][161] После прекращения приема количество сперматозоидов нормализовалось у мужчин в течение 14-17 недель.[25][157][153][159][161] В другом исследовании 100 мг ректальный суппозитории прогестерона, вводимого пять раз в день в течение 9 дней, приводило к уровню прогестерона от 5,5 до 29 нг / мл и подавлению циркуляции тестостерон и гормон роста уровни примерно на 50% у мужчин, но не повлияли на либидо или эректильную потенцию при такой короткой продолжительности терапии.[25][162]
Прогонадотропные эффекты
Прогестерон может иметь прогонадотропный эффекты при определенных обстоятельствах.[129]
Нейростероидные эффекты
Прогестерон, благодаря действию нейростероид активные метаболиты такие как аллопрегнанолон и прегнанолон, это мощный положительный аллостерический модулятор из ГАМКА рецептор, главный сигнальный рецептор тормозящий нейротрансмиттер γ-аминомасляная кислота (ГАМК).[16] Он может производить успокаивающее, гипнотический, анксиолитик, эйфорический, когнитивный, объем памяти-, и двигательный, противосудорожное средство, и даже анестетик эффекты с образованием достаточно высоких концентраций его метаболитов нейростероидов и, как следствие, ГАМКА потенцирование рецепторов в головном мозге.[40][102][103][104] Эти действия и эффекты характерно похожи на действия других ГАМКА рецептор-положительные аллостерические модуляторы любить алкоголь, барбитураты, и бензодиазепины.[104]
Аналогично другим ГАМКА рецептор-положительные аллостерические модуляторы, такие как алкоголь, барбитураты и бензодиазепины, толерантность Было обнаружено, что он развивается при воздействии повышенных уровней аллопрегнанолона и связанных с ним ингибирующих нейростероидов.[163][164] Это включает в себя подавление и десенсибилизация ГАМКА рецептор, снижение эффектов аллопрегнанолона и других ГАМКА активаторы рецепторов (например, ГАМК и бензодиазепины), и отскок или вывод эффекты при падении уровня аллопрегнанолона.[163][164] Кроме того, изменения в уровнях аллопрегнанолона были вовлечены в неблагоприятные психоневрологические эффекты, связанные с менструальный цикл (например., дисфория, депрессия, беспокойство, раздражительность ) и послеродовой период (например., послеродовая депрессия ), а также в менструальная эпилепсия (припадки ).[165][166] Низкий и высокий уровни аллопрегнанолона, по-видимому, оказывают нейтральное влияние на настроение, тогда как умеренные уровни имеют отрицательный эффект, который может лежать в основе симптомов предменструальный синдром и предменструальное дисфорическое расстройство которые наблюдаются у 30-40% женщин в пременопаузе.[165][166][167] Этот U-образный эффект на настроение, по-видимому, является общим свойством ГАМК.А рецептор-положительные аллостерические модуляторы.[165][166]
Смотрите также
использованная литература
- ^ Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Унфер, Витторио; ди Ренцо, Джан; Герли, Сандро; Казини, Мария (2006). «Использование прогестерона в клинической практике: оценка его эффективности при различных показаниях с использованием различных способов введения». Современная лекарственная терапия. 1 (2): 211–219. Дои:10.2174/157488506776930923. ISSN 1574-8855.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Уитакер, Эми; Гиллиам, Мелисса (2014). Контрацепция для подростков и молодых взрослых женщин. Springer. п. 98. ISBN 9781461465799.
- ^ Чаудхури (2007). Практика контроля фертильности: подробное руководство (7-е изд.). Эльзевир Индия. С. 153–. ISBN 978-81-312-1150-2.
- ^ Аттарди Б.Дж., Бургенсон Дж., Хилд С.А., Рил-младший (март 2004 г.). «Антипрогестационная / антиглюкокортикоидная активность in vitro и связывание с рецептором прогестина и глюкокортикоида предполагаемых метаболитов и синтетических производных CDB-2914, CDB-4124 и мифепристона». J. Steroid Biochem. Мол. Биол. 88 (3): 277–88. Дои:10.1016 / j.jsbmb.2003.12.004. PMID 15120421. S2CID 23958876.
- ^ Солтысик К., Чекай П. (апрель 2013 г.). «Мембранные рецепторы эстрогенов - альтернативный способ действия эстрогенов?». J. Physiol. Pharmacol. 64 (2): 129–42. PMID 23756388.
- ^ Просниц Э. Р., Бартон М. (май 2014 г.). «Биология эстрогенов: новое понимание функции GPER и клинических возможностей». Мол. Cell. Эндокринол. 389 (1–2): 71–83. Дои:10.1016 / j.mce.2014.02.002. ЧВК 4040308. PMID 24530924.
- ^ а б c Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, Holsboer F, Damm K (октябрь 1993 г.). «Фармакологическая и функциональная характеристика лигандов минералокортикоидных и глюкокортикоидных рецепторов человека». Европейский журнал фармакологии. 247 (2): 145–54. Дои:10.1016 / 0922-4106 (93) 90072-Н. PMID 8282004.
- ^ а б c Элгер В., Байер С., Поллоу К., Гарфилд Р., Ши С.К., Хиллиш А. (2003). «Концепция и фармакодинамический профиль дроспиренона». Стероиды. 68 (10–13): 891–905. Дои:10.1016 / j.steroids.2003.08.008. PMID 14667981. S2CID 41756726.
- ^ а б Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (2007). «Сравнение связывания рецепторов прогестерона и глюкокортикоидов и стимуляции экспрессии генов прогестероном, 17-альфа-гидроксипрогестерона капроатом и родственными прогестинами». Am. J. Obstet. Гинеколь. 197 (6): 599.e1–7. Дои:10.1016 / j.ajog.2007.05.024. ЧВК 2278032. PMID 18060946.
- ^ а б Лей К., Чен Л., Георгиу Э. С., Сооранна С. Р., Ханджани С., Бросенс Дж. Дж., Беннет П. Р., Джонсон М. Р. (2012). «Прогестерон действует через ядерный глюкокортикоидный рецептор, подавляя IL-1β-индуцированную экспрессию СОХ-2 в человеческих клетках миометрия». PLOS ONE. 7 (11): e50167. Bibcode:2012PLoSO ... 750167L. Дои:10.1371 / journal.pone.0050167. ЧВК 3509141. PMID 23209664.
- ^ а б Болье Э, Шумахер М (2000). «Прогестерон как нейроактивный нейростероид с особым упором на влияние прогестерона на миелинизацию». Стероиды. 65 (10–11): 605–12. Дои:10.1016 / s0039-128x (00) 00173-2. PMID 11108866. S2CID 14952168.
- ^ Морис Т., Урани А., Фан В.Л., Ромье П. (ноябрь 2001 г.). «Взаимодействие между нейроактивными стероидами и функцией рецептора сигма1: поведенческие последствия и терапевтические возможности». Исследование мозга. Обзоры исследований мозга. 37 (1–3): 116–32. Дои:10.1016 / s0165-0173 (01) 00112-6. PMID 11744080. S2CID 44931783.
- ^ Йоханнесен М., Фонтанилла Д., Мавлютов Т., Руохо А.Е., Джексон МБ (февраль 2011 г.). «Антагонистическое действие прогестерона на σ-рецепторы при модуляции потенциал-управляемых натриевых каналов». Американский журнал физиологии. Клеточная физиология. 300 (2): C328-37. Дои:10.1152 / ajpcell.00383.2010. ЧВК 3043630. PMID 21084640.
- ^ а б Пол С.М., Парди Р.Х. (март 1992 г.). «Нейроактивные стероиды». Журнал FASEB. 6 (6): 2311–22. Дои:10.1096 / fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Knörr K, Beller FK, Lauritzen C (17 апреля 2013 г.). Lehrbuch der Gynäkologie. Springer-Verlag. С. 214–. ISBN 978-3-662-00942-0.
- ^ Knörr K, Knörr-Gärtner H, Beller FK, Lauritzen C (8 марта 2013 г.). Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. С. 583–. ISBN 978-3-642-95583-9.
- ^ А. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. С. 554–. ISBN 978-3-642-96158-8.
- ^ Horský J, Presl J (1981). «Гормональное лечение нарушений менструального цикла». В Horsky J, Presl K (ред.). Функция яичников и ее нарушения: диагностика и лечение. Springer Science & Business Media. С. 309–332. Дои:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Иоахим Уфер (1969). Принципы и практика гормональной терапии в гинекологии и акушерстве. де Грюйтер. п. 49.
17α-гидроксипрогестерона капроат является депо-гестагеном, не имеющим побочных действий. Доза, необходимая для индукции секреторных изменений в примированном эндометрии, составляет около 250 мг. за менструальный цикл.
- ^ Виллибальд Пшайрембель (1968). Praktische Gynäkologie: für Studierende und Ärzte. Вальтер де Грюйтер. С. 598, 601. ISBN 978-3-11-150424-7.
- ^ Ферин Дж (сентябрь 1972 г.). «Эффекты, продолжительность действия и метаболизм у человека». В Тауск М (ред.). Фармакология эндокринной системы и родственные препараты: прогестерон, препараты для прогестации и противозачаточные средства. II. Pergamon Press. С. 13–24. ISBN 978-0080168128. OCLC 278011135.
- ^ Хенцл М.Р., Эдвардс Дж. А. (10 ноября 1999 г.). «Фармакология прогестинов: производные 17α-гидроксипрогестерона и прогестины первого и второго поколения». В Sitruk-Ware R, Mishell DR (ред.). Прогестины и антипрогестины в клинической практике. Тейлор и Фрэнсис. С. 101–132. ISBN 978-0-8247-8291-7.
- ^ а б c d е Джанет Браттон (1976). Фармакология половых гормонов. Академическая пресса. п. 114. ISBN 978-0-12-137250-7. Ошибка цитирования: указанная ссылка "Brotherton1976" была определена несколько раз с разным содержанием (см. страница помощи).
- ^ Пел GW (апрель 1994). «Фармакодинамические эффекты вводимых один раз в месяц комбинированных инъекционных контрацептивов». Контрацепция. 49 (4): 361–85. Дои:10.1016/0010-7824(94)90033-7. PMID 8013220.
- ^ Toppozada MK (апрель 1994). «Существующие раз в месяц комбинированные инъекционные контрацептивы». Контрацепция. 49 (4): 293–301. Дои:10.1016/0010-7824(94)90029-9. PMID 8013216.
- ^ Багаде О, Павар В., Пател Р., Пател Б., Авасаркар В., Дивейт С. (2014). «Увеличение использования обратимых контрацептивов длительного действия: безопасный, надежный и экономичный контроль над рождаемостью» (PDF). World J Pharm Pharm Sci. 3 (10): 364–392. ISSN 2278-4357. Архивировано из оригинал (PDF) на 2017-08-10. Получено 2016-08-24.
- ^ Goebelsmann U (1986). «Фармакокинетика противозачаточных стероидов у людей». В Gregoire AT, Blye RP (ред.). Противозачаточные стероиды: фармакология и безопасность. Springer Science & Business Media. С. 67–111. Дои:10.1007/978-1-4613-2241-2_4. ISBN 978-1-4613-2241-2.
- ^ Беккер H, Дюстерберг B, Клостерхалфен H (1980). «[Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин (авторский перевод)]» [Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин]. Urologia Internationalis. 35 (6): 381–5. Дои:10.1159/000280353. PMID 6452729.
- ^ Мольц Л., Хаазе Ф., Шварц Ю., Хаммерштейн Дж. (Май 1983 г.). «[Лечение вирилизованных женщин с внутримышечным введением ципротерона ацетата]» [Эффективность внутримышечно применяемого ципротерона ацетата при гиперандрогении]. Geburtshilfe Und Frauenheilkunde. 43 (5): 281–7. Дои:10.1055 / с-2008-1036893. PMID 6223851.
- ^ Райт Дж. С., Берджесс диджей (29 января 2012 г.). Инъекции и имплантаты длительного действия. Springer Science & Business Media. С. 114–. ISBN 978-1-4614-0554-2.
- ^ Чу Й.Х., Ли Ц., Чжао Ц.Ф. (апрель 1986 г.). «Фармакокинетика мегестрола ацетата у женщин, получающих внутримышечно инъекционный контрацептив эстрадиол-мегестрола длительного действия». Китайский журнал клинической фармакологии.
Результаты показали, что после инъекции концентрация МА в плазме быстро увеличивалась. Среднее время пикового уровня МА в плазме составляло 3-й день, наблюдалась линейная зависимость между логарифмом концентрации МА в плазме и временем (днем) после введения у всех субъектов, период полувыведения фазы элиминации t1 / 2β = 14,35 ± 9,1 дня.
- ^ Раннебаум BC, Рабе Т., Кизель Л. (6 декабря 2012 г.). Женская контрацепция: новости и тенденции. Springer Science & Business Media. С. 429–. ISBN 978-3-642-73790-9.
- ^ Артини П.Г., Генаццани А.Р., Петралья Ф. (11 декабря 2001 г.). Достижения в гинекологической эндокринологии. CRC Press. С. 105–. ISBN 978-1-84214-071-0.
- ^ Кинг Т.Л., Брукер М.С., Крибс Дж. М., Фэхи Дж. О. (21 октября 2013 г.). Акушерство Варни. Издательство "Джонс и Бартлетт". С. 495–. ISBN 978-1-284-02542-2.
- ^ а б c Элькик Ф., Мове-Джарвис П. (январь 1980 г.). «Роль прогестерона и прогестатов на гидроэлектролитическом метаболизме» [Роль прогестерона и прогестинов в гидроэлектролитическом метаболизме]. Nouv Presse Med (На французском). 9 (1): 35–8. PMID 6986604.
- ^ а б Краттенмахер Р. (июль 2000 г.). «Дроспиренон: фармакология и фармакокинетика уникального прогестагена». Контрацепция. 62 (1): 29–38. Дои:10.1016 / S0010-7824 (00) 00133-5. PMID 11024226.
- ^ а б c Саймон Дж. А. (декабрь 1995 г.). «Микронизированный прогестерон: вагинальное и оральное применение». Клиническое акушерство и гинекология. 38 (4): 902–14. Дои:10.1097/00003081-199538040-00024. PMID 8616985.
- ^ а б c d Голетиани Н.В., Кейт Д.Р., Горский С.Дж. (2007). «Прогестерон: обзор безопасности для клинических исследований». Exp Clin Psychopharmacol. 15 (5): 427–44. Дои:10.1037/1064-1297.15.5.427. PMID 17924777.
- ^ а б Элкерс В. (2000). «Дроспиренон - новый прогестаген с антиминералокортикоидной активностью, напоминающий природный прогестерон». Eur J Contracept Reprod Health Care. 5 Дополнение 3: 17–24. PMID 11246598.
- ^ Zerr-Fouineau M, Chataigneau M, Blot C, Schini-Kerth VB (январь 2007 г.). «Прогестины преодолевают ингибирование агрегации тромбоцитов эндотелиальными клетками путем подавления эндотелиальной NO-синтазы через глюкокортикоидные рецепторы». FASEB J. 21 (1): 265–73. Дои:10.1096 / fj.06-6840com. PMID 17116740. S2CID 22679638.
- ^ а б Fuhrmann U, Krattenmacher R, Slater EP, Fritzemeier KH (октябрь 1996 г.). «Новый прогестин дроспиренон и его естественный аналог прогестерон: биохимический профиль и антиандрогенный потенциал». Контрацепция. 54 (4): 243–51. Дои:10.1016 / с0010-7824 (96) 00195-3. PMID 8922878.
Дроспиренон и прогестерон проявляли низкую аффинность связывания с ГР крысы, что подтверждается значениями RBA 1% и 11% по сравнению с эталонным дексаметазоном, соответственно. Аналогичные результаты были получены в другом месте.8 В соответствии с низким сродством к GR прогестерон и дроспиренон показали слабую или не обнаруживаемую агонистическую активность, соответственно, в анализе GR-зависимой трансактивации (Рисунок 2A и Рисунок 2B). Кроме того, оба прогестина были лишены антиглюкокортикоидной активности in vitro. Эти данные согласуются с исследованиями in vivo, проведенными на крысах, в которых дроспиренон и прогестерон не проявляли ни глюкокортикоидной, ни антиглюкокортикоидной активности.
- ^ Wiegratz I, Kuhl H (август 2004 г.). «Прогестагенная терапия: различия в клинических эффектах?». Тенденции Endocrinol. Метаб. 15 (6): 277–85. Дои:10.1016 / j.tem.2004.06.006. PMID 15358281. S2CID 35891204.
- ^ а б c d е ж Йе Ю.Т., Чанг К.В., Вэй Р.Дж., Ван С.Н. (2013). «Прогестерон и родственные соединения при гепатоцеллюлярной карциноме: основные и клинические аспекты». Биомед Рес Инт. 2013: 290575. Дои:10.1155/2013/290575. ЧВК 3581253. PMID 23484104.
- ^ а б c Ottosson UB (1984). «Пероральная терапия прогестероном и эстрогеном / прогестагеном. Влияние природных и синтетических гормонов на субфракции холестерина ЛПВП и белков печени». Acta Obstet Gynecol Scand Suppl. 127: 1–37. Дои:10.3109/00016348409157016. PMID 6596830. S2CID 26138417.
Природный прогестерон лишен какой-либо андрогенной активности, которая может нарушить метаболизм липопротеинов или вызвать тератогенность.
- ^ Зутши (2005). Гормоны в акушерстве и гинекологии. Jaypee Brothers, медицинские издательства. С. 74–75. ISBN 978-81-8061-427-9.
Было замечено, что микронизированный прогестерон не оказывает подавляющего действия на холестерин липопротеинов высокой плотности (ЛПВП). Jensen et al. Доказали, что микронизированный прогестерон при пероральном приеме не оказывает вредного воздействия на липиды сыворотки. Эти препараты обладают одинаковым антиэстрогенным и антиминералокортикоидным действием, но не обладают андрогенным действием. Он не влияет на синтез альдостерона, артериальное давление, углеводный обмен или изменения настроения. Не сообщалось о побочных эффектах в отношении липидного профиля, факторов свертывания и артериального давления.
- ^ Леви Т., Яири Ю., Бар-Хава И., Шалев Дж., Орвието Р., Бен-Рафаэль З. (2000). «Фармакокинетика вагинальных таблеток, содержащих прогестерон, и их использование при вспомогательной репродукции» (PDF). Стероиды. 65 (10–11): 645–9. Дои:10.1016 / s0039-128x (00) 00121-5. PMID 11108871. S2CID 9627000.
Природный прогестерон не обладает андрогенной активностью и поэтому широко используется при вспомогательной репродукции, иногда в течение длительных периодов времени.
- ^ Самсиоэ, Горан; Дерен, Мартина; Лобо, Роджерио А (2006). «Заместительная гормональная терапия - средства». Медицина женского здоровья. 3 (5): 213–216. Дои:10.1053 / S1744-1870 (06) 70207-4. ISSN 1744-1870.
Прогестагены различаются по своему относительному метаболическому и андрогенному действию; например, MPA минимально андроген, но противодействует повышению уровня HDL-холестерина, вызванному терапией эстрогенами. Напротив, пероральный микронизированный прогестерон не смягчает повышенный уровень холестерина ЛПВП.
- ^ а б Вудс К.С., Рейна Р., Аззиз Р. (2002). «Влияние перорального микронизированного прогестерона на уровни андрогенов у женщин с синдромом поликистозных яичников». Fertil. Стерил. 77 (6): 1125–7. Дои:10.1016 / s0015-0282 (02) 03119-9. PMID 12057716.
Средние значения TT, FT, SHBG, DHEAS, A4 и 17-OHP не изменились при введении OMP. Однако более высокий уровень 17-ОНР наблюдался по завершении введения ОМП (2 неделя).
- ^ Sitruk-Ware R (2002). «Прогестагены в заместительной гормональной терапии: новые молекулы, риски и преимущества». Менопауза. 9 (1): 6–15. Дои:10.1097/00042192-200201000-00003. PMID 11791081. S2CID 12136231.
- ^ а б Сумино, Хироюки; Итикава, Шуичи; Касама, Шу; Такахаши, Такаши; Кумакура, Хисао; Такаяма, Ёсиаки; Минами, Кадзутомо; Канда, Цугиясу; Курабаяси, Масахико; Мураками, Масами (2011). «Гормональная терапия и артериальное давление у женщин в постменопаузе». Журнал экспериментальной и клинической медицины. 3 (3): 112–115. Дои:10.1016 / j.jecm.2011.04.005. ISSN 1878-3317.
Природный прогестерон, такой как микронизированный прогестерон, не обладает андрогенными свойствами, тогда как некоторые синтетические прогестины, такие как МПА и норэтистерона ацетат, обладают андрогенными побочными эффектами, что вызывает опасения по поводу потенциально вредного воздействия на артериальное давление.
- ^ Walch KT, Huber JC (апрель 2008 г.). «Прогестерон при повторном невынашивании беременности: правда и обман». Лучшая практика Res Clin Obstet Gynaecol. 22 (2): 375–89. Дои:10.1016 / j.bpobgyn.2007.08.009. PMID 17964858.
- ^ Роде Л., Лангхофф-Роос Дж., Андерссон С., Динесен Дж., Хаммерум М.С., Мохапелоа Х., Табор А (2009). «Систематический обзор прогестерона для профилактики преждевременных родов при одноплодной беременности». Acta Obstet Gynecol Scand. 88 (11): 1180–9. Дои:10.3109/00016340903280982. PMID 19900136. S2CID 556588.
- ^ а б c Хэггстрем, Микаэль; Ричфилд, Дэвид (2014). «Схема путей стероидогенеза человека». WikiJournal of Медицина. 1 (1). Дои:10.15347 / wjm / 2014.005. ISSN 2002-4436.
- ^ а б Сэмюэл Б. Франк (1971). Юношеские угри. Томас. п. 131.
Химическая структура прогестерона и тестостерона очень похожа; они различаются только боковой цепью в 17-углеродном положении. Возможность того, что прогестерон может быть преобразован в тестостерон, многими считалась хорошей. Если это правда, то он может быть источником андрогенов у женщин. [...] Существуют лабораторные данные о том, что прогестерон может превращаться в тестостерон in vitro в тканях яичников и яичек человека и животных.44-47 Хотя роль прогестерона в развитии угрей и его влияние на активность сальных желез не полностью установлено, возможность тот факт, что эндогенный прогестерон является предшественником тестостерона или другого андрогенного вещества, требует дальнейшего изучения (48,49).
- ^ Vermorken, A. J. M .; Хубен, Дж. Дж. Г. (2016). «Актуальное андрогенное лечение акне - обзор». Анализ лекарственных средств и клиническая аптека. 12 (3): 151–157. Дои:10.1177/106002807801200302. ISSN 0012-6578. S2CID 74413605.
Единственное беспокойство, которое Фойгт и Ся выразили по поводу использования прогестерона в качестве антиандрогена, заключалась в возможности того, что небольшое количество гормона, попавшее в кровоток, могло быть преобразовано в тестостерон половыми органами, в основном яичками.
- ^ Шуфэн Чжоу (6 апреля 2016 г.). Цитохром P450 2D6: структура, функция, регуляция и полиморфизм. CRC Press. С. 52–. ISBN 978-1-4665-9788-4.
- ^ а б Уайтхед М.И., Таунсенд П.Т., Гилл Д.К., Коллинз В.П., Кэмпбелл С. (1980). «Поглощение и метаболизм прогестерона при приеме внутрь». Br Med J. 280 (6217): 825–7. Дои:10.1136 / bmj.280.6217.825. ЧВК 1600943. PMID 7370683.
Концентрация эстрадиола в плазме крови не изменилась при введении прогестерона.
- ^ Рижнер Т.Л., Брожич П., Дусетт С., Турек-Этьен Т., Мюллер-Виейра Ю., Зонневельд Е., ван дер Бург Б., Бёкер С., Хусен Б. (май 2011 г.). «Селективность и эффективность ретропрогестерона дидрогестерона in vitro». Стероиды. 76 (6): 607–15. Дои:10.1016 / j.steroids.2011.02.043. PMID 21376746. S2CID 31609405.
- ^ Свердлов Р.С., Дадли Р.Э., Пейдж СТ, Ван С., Саламе В.А. (2017). «Дигидротестостерон: биохимия, физиология и клинические последствия повышенного уровня в крови». Endocr. Rev. 38 (3): 220–254. Дои:10.1210 / er.2016-1067. ЧВК 6459338. PMID 28472278.
- ^ а б Маркс Л.С. (2004). «5α-редуктаза: история болезни и клиническое значение». Преподобный Урол. 6 Дополнение 9: S11–21. ЧВК 1472916. PMID 16985920.
- ^ Голуб М.С., Кауфман Флорида, Кэмпбелл М.А., Ли Л.Х., Дональд Дж.М. (октябрь 2006 г.). ""Натуральный «прогестерон: информация о влиянии на плод». Исследование врожденных дефектов, часть B: токсикология развития и репродуктивной системы. 77 (5): 455–70. Дои:10.1002 / bdrb.20089. PMID 17066418.
Было показано, что прогестерон ингибирует 5α-редуктазу, еще один важный фермент в метаболизме стероидных гормонов (Dean and Winter, 1984; Beckmann et al., 1993; Cassidenti et al., 1991; Kadohama et al., 1983; Mauvais-Jarvis et al. др., 1974; Дубе и др., 1975). Однако это слабый эффект, который был продемонстрирован только при надфизиологических концентрациях и в условиях in vitro.
- ^ Кинкл, Фред А. (1990). «Контроль репродуктивной функции у взрослых». Гормональная токсичность у новорожденных. Монографии по эндокринологии. 31. С. 5–120. Дои:10.1007/978-3-642-83794-4_2. ISBN 978-3-642-83796-8. ISSN 0077-1015. PMID 1965221.
Прогестерон (и другие гестагенные агенты) подавляют экспрессию тестостерона своей активности в целевых сайтах (Kincl, 1971a). Мыши и крысы являются предпочтительными подопытными животными (Dorfman, 1963a, b). Было показано, что ингибирование активности связывания 5α-редуктазы с цитозолем и ядерными рецепторами является стадией, на которой антиандрогены проявляют свою активность (Neumann and Steinbeck, 1974). Для достижения значительного эффекта необходимы относительно большие количества (таблица 2.16).
- ^ Дьюис П., Ньюман М., Андерсон, округ Колумбия (октябрь 1984 г.). «Влияние эндогенного прогестерона на сывороточные уровни 5α-восстановленных андрогенов у гирсутированных женщин». Clin. Эндокринол. (Oxf). 21 (4): 383–92. Дои:10.1111 / j.1365-2265.1984.tb03225.x. PMID 6542470. S2CID 72895292.
Эти исследования показывают, что [...] повышение сывороточного прогестерона оказывает лишь минимальное влияние на циркулирующие уровни активных 5α-восстановленных метаболитов андрогенов. [...] Прогестерон оказался мощным ингибитором кожной 5α-редуктазы in vitro (Mauvais-Jarvis et al., 1974). Однако мы обнаружили лишь небольшое снижение уровней ДГТ в сыворотке на поздней лютеиновой фазе у овуляторных женщин и отсутствие изменений в сыворотке 3α-диола. Следовательно, повышение уровня прогестерона в сыворотке у овуляторных женщин оказывает лишь минимальное влияние на циркулирующие уровни основных активных 5α-восстановленных андрогенов in vivo.
- ^ Колунд-Йенсен Х., Мирен С.Дж. (декабрь 1984 г.). «Вагинальная абсорбция эстрадиола и прогестерона». Maturitas. 6 (4): 359–67. Дои:10.1016/0378-5122(84)90009-4. PMID 6543461.
- ^ Picut CA, Ziejewski MK, Stanislaus D (февраль 2018 г.). «Сравнительные аспекты дородового и постнатального развития мужской репродуктивной системы». Врожденные дефекты Res. 110 (3): 190–227. Дои:10.1002 / bdr2.1133. PMID 29063715. S2CID 3967093.
- ^ а б Sitruk-Ware R (август 2018). «Доклинические исследования прогестерона». Климактерический. 21 (4): 315–320. Дои:10.1080/13697137.2018.1463982. ЧВК 6281289. PMID 29790373.
- ^ Фред А. Кинкл (6 декабря 2012 г.). Гормональная токсичность у новорожденных. Springer Science & Business Media. п. 60. ISBN 978-3-642-83794-4.
- ^ Кавасима К., Накаура С., Нагао С., Танака С., Кувамура Т. (февраль 1977 г.). «Вирилизирующая активность различных стероидов у плодов самок крыс». Эндокринол. JPN. 24 (1): 77–81. Дои:10.1507 / endocrj1954.24.77. PMID 558879.
- ^ а б c d е ж г Aufrère MB, Benson H (июнь 1976 г.). «Прогестерон: обзор и последние достижения». J Pharm Sci. 65 (6): 783–800. Дои:10.1002 / jps.2600650602. PMID 945344.
Ранние исследования его использования в качестве орального контрацептива показали, что прогестерон в дозе 300 мг / день (с 5-го по 25-й день менструального цикла) эффективно предотвращал овуляцию в течение четырех циклов (263). Связанное с этим влияние больших доз прогестерона на выведение гонадотропинов также было исследовано. Ротшильд (264) обнаружил, что непрерывное или прерывистое внутривенное введение прогестерона (100-400 мг / день) в течение 10 дней снижает общее количество гонадотропина, выделяемого с мочой. Однако Paulsen et al. (265) обнаружили, что пероральный прогестерон в дозе 1000 мг / день в течение 87 дней не оказывал значительного влияния на экскрецию гонадотропинов с мочой. Эффективность прогестерона в качестве перорального контрацептива никогда полностью не тестировалась, поскольку были доступны синтетические прогестагенные агенты, которые были эффективны при пероральном приеме.
- ^ Тони М. Плант; Энтони Дж. Зелезник (15 ноября 2014 г.). Физиология репродукции Кнобила и Нила. Академическая пресса. С. 2289, 2386. ISBN 978-0-12-397769-4.
- ^ Гормоны, мозг и поведение, набор из пяти томов. Эльзевир. 18 июня 2002. С. 54–. ISBN 978-0-08-053415-2.
- ^ Heidrich A, Schleyer M, Spingler H, Albert P, Knoche M, Fritze J, Lanczik M (февраль 1994).«Послеродовая хандра: взаимосвязь между стероидными гормонами, не связанными с белками, в плазме крови и послеродовыми изменениями настроения». J влияет на Disord. 30 (2): 93–8. Дои:10.1016/0165-0327(94)90036-1. PMID 8201129.
- ^ Baek, K .; Rosenwaks, Z .; Poppas, D.P .; Палермо, Г.Д. (2006). «П-657». Фертильность и бесплодие. 86 (3): S377. Дои:10.1016 / j.fertnstert.2006.07.1033. ISSN 0015-0282.
- ^ Фармакология кожи I: фармакология аутокоидов кожных систем нормальной и воспаленной кожи. Springer Science & Business Media. 6 декабря 2012. С. 249–250. ISBN 978-3-642-73797-8.
- ^ а б Фармакология кожи II: методы, абсорбция, метаболизм и токсичность, лекарственные препараты и заболевания. Springer Science & Business Media. 6 декабря 2012. С. 253, 485–. ISBN 978-3-642-74054-1.
- ^ а б Уолтер П. Унгер (1 февраля 1995 г.). «Андрогенетическая алопеция и ее лечение. Исторический обзор». Трансплантация волос, третье издание. Тейлор и Фрэнсис. С. 1–33. ISBN 978-0-8247-9363-0.
- ^ а б Савая, Марти Э .; Шапиро, Джерри (2000). «Андрогенетическая алопеция». Дерматологические клиники. 18 (1): 47–61. Дои:10.1016 / S0733-8635 (05) 70146-7. ISSN 0733-8635. PMID 10626111.
- ^ Партхасарати, Саудхамини; Чин, Андреа; Маллой, Вирджиния; Матиас, Джонатан (1988). «Аффинность связывания рецептора андрогена in vitro и ингибирующая активность 5β-прегнана-3, 20-диона in vivo». Летопись Нью-Йоркской академии наук. 529 (1 четвертый коллок): 239–241. Bibcode:1988НЯСА.529..239П. Дои:10.1111 / j.1749-6632.1988.tb51470.x. ISSN 0077-8923. S2CID 86039350.
- ^ Цена, Вера Х. (1988). «Современное состояние андрогенной алопеции и стимулирования роста волос: настоящее и будущее». Клиники дерматологии. 6 (4): 218–227. Дои:10.1016 / 0738-081X (88) 90090-9. ISSN 0738-081X. PMID 3063373.
- ^ Савая М.Е., Гординский М.К. (январь 1993 г.). «Антиандрогены. Когда и как их использовать». Дерматол Клин. 11 (1): 65–72. Дои:10.1016 / S0733-8635 (18) 30283-3. PMID 8435919.
- ^ а б c Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, Fehm T., Mueck AO (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака груди». Климактерический. 16 (5): 509–13. Дои:10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
- ^ Руан X, Нойбауэр Х., Ян Й., Шнек Х., Шульц С., Фем Т., Кэхилл М.А., Сигер Х., Муек А.О. (октябрь 2012 г.). «Прогестагены и мембранно-инициированные эффекты на пролиферацию клеток рака груди человека». Климактерический. 15 (5): 467–72. Дои:10.3109/13697137.2011.648232. PMID 22335423. S2CID 11302554.
- ^ а б c d Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (сентябрь 2019 г.). «Прогестерон и рак груди». Endocr. Rev. 41 (2): 320–344. Дои:10.1210 / endrev / bnz001. ЧВК 7156851. PMID 31512725.
- ^ а б c П. Дж. Бентли (1980). Эндокринная фармакология: физиологические основы и терапевтическое применение. КУБОК Архив. С. 264, 274. ISBN 978-0-521-22673-8.
- ^ а б Марк А. Сперлинг (10 апреля 2014 г.). Электронная книга по детской эндокринологии. Elsevier Health Sciences. стр. 630–. ISBN 978-1-4557-5973-6.
- ^ Сью Макдональд; Гейл Джонсон (3 июня 2017 г.). Электронная книга по акушерству Mayes '. Elsevier Health Sciences. С. 391–. ISBN 978-0-7020-6336-7.
- ^ Кеннет Л. Беккер (2001). Принципы и практика эндокринологии и метаболизма. Липпинкотт Уильямс и Уилкинс. С. 889, 940. ISBN 978-0-7817-1750-2.
- ^ Ли-Эллен К. Копстед-Киркхорн; Жаклин Л. Банасик (25 июня 2014 г.). Патофизиология - Электронная книга. Elsevier Health Sciences. стр. 660–. ISBN 978-0-323-29317-4.
В репродуктивном возрасте некоторые женщины отмечают набухание груди в конце каждого менструального цикла перед началом менструации. Считается, что задержка воды и последующий отек тканей груди во время этой фазы менструального цикла связаны с высоким уровнем циркулирующего прогестерона, стимулирующего секреторные клетки груди.
- ^ Фараж М.А., Нил С., Маклин А.Б. (2009). «Физиологические изменения, связанные с менструальным циклом: обзор». Акушерское гинекологическое обследование. 64 (1): 58–72. Дои:10.1097 / OGX.0b013e3181932a37. PMID 19099613. S2CID 22293838.
- ^ Рейн-Феннинг, штат Нью-Джерси, член парламента Бринката, Маскат-барон Y (2003). «Старение кожи и менопауза: значение для лечения». Am J Clin Dermatol. 4 (6): 371–8. Дои:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB, Schmidt B (2005). «Эффекты и побочные эффекты 2% крема с прогестероном на коже женщин в пери- и постменопаузе: результаты двойного слепого рандомизированного исследования с контролем носителя». Br. J. Dermatol. 153 (3): 626–34. Дои:10.1111 / j.1365-2133.2005.06685.x. PMID 16120154. S2CID 6077829.
- ^ а б Леон Сперофф; Марк А. Фриц (2005). Клиническая гинекологическая эндокринология и бесплодие. Липпинкотт Уильямс и Уилкинс. С. 211–. ISBN 978-0-7817-4795-0.
При введении перед стимуляцией эстрогеном или в высоких дозах (достижение уровня в крови более 2 нг / мл) прогестерон блокирует выброс ЛГ в середине цикла.
- ^ Чарльз Р. Б. Бекманн; Уильям Герберт; Дуглас Лаубе; Фрэнк Линг, Роджер Смит (21 января 2013 г.). Акушерство и гинекология. Липпинкотт Уильямс и Уилкинс. С. 342–. ISBN 978-1-4698-2604-2.
- ^ Куигли MM (август 1986 г.). «Препараты в лечении женского бесплодия. Последние достижения». Наркотики. 32 (2): 169–77. Дои:10.2165/00003495-198632020-00004. PMID 3527660. S2CID 46972235.
При наличии в крови прогестерона примерно 4 мкг / л или выше у большинства женщин наблюдается повышение базальной температуры тела на 0,5–1 ° F.
- ^ Шанафельт Т.Д., Бартон Д.Л., Аджей А.А., Лопринзи С.Л. (2002). «Патофизиология и лечение приливов». Mayo Clin. Proc. 77 (11): 1207–18. Дои:10.4065/77.11.1207. PMID 12440557.
- ^ Сассарини Дж, Ламсден Массачусетс (2010). «Приливы: есть ли эффективные альтернативы эстрогену?». Менопауза Инт. 16 (2): 81–8. Дои:10.1258 / миль.2010.010007. PMID 20729500. S2CID 37505358.
- ^ Бейлисс Д.А., Миллхорн Д.Е. (1992). «Центральные нервные механизмы действия прогестерона: приложение к дыхательной системе». J. Appl. Физиол. 73 (2): 393–404. Дои:10.1152 / jappl.1992.73.2.393. PMID 1399957.
- ^ Гада Бурджили; Карен Розене-Монтелла (21 апреля 2009 г.). Легочные проблемы при беременности. Springer Science & Business Media. С. 21–. ISBN 978-1-59745-445-2.
- ^ а б Gompel A, Plu-Bureau G (август 2018 г.). «Прогестерон, прогестины и грудь в лечении менопаузы». Климактерический. 21 (4): 326–332. Дои:10.1080/13697137.2018.1476483. PMID 29852797. S2CID 46922084.
- ^ а б Ван-Ченг Р., Нойнер Дж. М., Барнабей В. М. (2007). Менопауза. ACP Press. п. 97. ISBN 978-1-930513-83-9.
- ^ а б Бергеманн Н., Арихер-Рёсслер А. (27 декабря 2005 г.). Эффекты эстрогенов при психических расстройствах. Springer Science & Business Media. п. 179. ISBN 978-3-211-27063-9.
- ^ а б c Бэкстрем Т., Биксо М., Йоханссон М., Нюберг С., Оссеваарде Л., Рагагнин Г., Савич И., Стремберг Дж., Тимби Е., ван Брукховен Ф., ван Винген Г. (2014). «Аллопрегнанолон и расстройства настроения». Прог. Нейробиол. 113: 88–94. Дои:10.1016 / j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084.
- ^ Эрик Дж. Бибер; Джозеф С. Санфилиппо; Ира Р. Горовиц; Махмуд И. Шафи (23 апреля 2015 г.). Клиническая гинекология. Издательство Кембриджского университета. С. 972–. ISBN 978-1-107-04039-7.
- ^ Сьюзан Такер Блэкберн (2007). Физиология матери, плода и новорожденного: клиническая перспектива. Elsevier Health Sciences. С. 44–. ISBN 978-1-4160-2944-1.
- ^ Дж. Ларри Джеймсон; Лесли Дж. Де Гроот (25 февраля 2015 г.). Эндокринология: электронная книга для взрослых и детей. Elsevier Health Sciences. стр. 1–. ISBN 978-0-323-32195-2.
- ^ Ховард Карп (13 июня 2007 г.). Рецидивирующая потеря беременности: причины, противоречия и лечение. CRC Press. С. 79–. ISBN 978-0-415-42130-0.
- ^ а б Гаутам Н Аллахбадия; Рита Басурай Дас; Горал Ганди; Рубина Мерчант (17 июля 2017 г.). Искусство и наука вспомогательных репродуктивных технологий (ВРТ). JP Medical Ltd. стр. 145–. ISBN 978-93-86322-82-1.
- ^ Ларс Филип Бенгтссон; М. Тауск (30 января 1971 г.). Фармакология эндокринной системы и родственные препараты: прогестерон, гестагенные препараты и средства против оплодотворения.. Pergamon Press. п. 449.
- ^ а б de Ziegler D, Sator M, Binelli D, Leuratti C, Cometti B, Bourgain C, Fu YS, Garhöfer G (сентябрь 2013 г.). «Рандомизированное испытание, сравнивающее эффекты на эндометрий ежедневного подкожного введения 25 мг и 50 мг прогестерона в водном препарате». Fertil. Стерил. 100 (3): 860–6. Дои:10.1016 / j.fertnstert.2013.05.029. PMID 23806850.
- ^ а б c d де Зиглер Д., Фанчин Р. (2000). «Прогестерон и прогестины: применение в гинекологии». Стероиды. 65 (10–11): 671–9. Дои:10.1016 / s0039-128x (00) 00123-9. PMID 11108875. S2CID 5867301.
- ^ Станчик ФЗ (2014). «Лечение женщин в постменопаузе местными кремами и гелями с прогестероном: эффективны ли они?». Климактерический. 17 Дополнение 2: 8–11. Дои:10.3109/13697137.2014.944496. PMID 25196424. S2CID 20019151.
- ^ Станчик Ф.З., Полсон Р.Дж., Рой С. (2005). «Чрескожное введение прогестерона: уровни в крови и защита эндометрия». Менопауза. 12 (2): 232–7. Дои:10.1097/00042192-200512020-00019. PMID 15772572. S2CID 10982395.
- ^ Гаутам Н. Аллахбадия; Ёсихару Моримото (15 сентября 2015 г.). Протоколы стимуляции яичников. Springer. С. 137–. ISBN 978-81-322-1121-1.
- ^ Деврой П., Палермо Г., Бургейн С., Ван Вэсберге Л., Смитц Дж., Ван Штайртегем А.С. (1989). «Назначение прогестерона пациентам с отсутствием яичников». Int. Дж. Фертил. 34 (3): 188–93. PMID 2567713.
- ^ Стют П., Нойлен Дж., Вильдт Л. (август 2016 г.). «Влияние микронизированного прогестерона на эндометрий: систематический обзор». Климактерический. 19 (4): 316–28. Дои:10.1080/13697137.2016.1187123. PMID 27277331.
- ^ Дэйви Д.А. (октябрь 2018 г.). «Гормональная терапия в период менопаузы: лучшее и безопасное будущее». Климактерический. 21 (5): 454–461. Дои:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ а б Паскуалини-младший (2007). «Прогестины и рак груди». Гинеколь. Эндокринол. 23 Дополнение 1: 32–41. Дои:10.1080/09513590701585003. PMID 17943537. S2CID 46634314.
- ^ а б Паскуалини-младший (2009). «Рак молочной железы и ферменты, метаболизирующие стероиды: роль прогестагенов». Maturitas. 65 Дополнение 1: S17–21. Дои:10.1016 / j.maturitas.2009.11.006. PMID 19962254.
- ^ Коперник Г., Шохам З. (июнь 2004 г.). «Инструменты для принятия правильных решений относительно гормональной терапии. Часть II. Реакция органов и клиническое применение». Fertil. Стерил. 81 (6): 1458–77. Дои:10.1016 / j.fertnstert.2003.09.080. PMID 15193461.
- ^ de Lignières B (сентябрь 2002 г.). «Влияние прогестагенов на грудь в постменопаузе». Климактерический. 5 (3): 229–35. Дои:10.1080/713605271. PMID 12419080.
- ^ Баррат Дж, де Линьер Б., Марпо Л., Ларю Л., Фурнье С., Нахуль К., Линарес Г., Джорджи Х., Контессо Г. (1990). «Эффект локального введения прогестерона in vivo на основе митотической активности галактофоров человека: результаты местного применения прогестерона» [Влияние местного введения прогестерона на митотическую активность протоковой ткани молочной железы человека. Результаты пилотного исследования. J Gynecol Obstet Biol Reprod (Париж) (На французском). 19 (3): 269–74. PMID 2345268.
- ^ Chang KJ, Lee TT, Linares-Cruz G, Fournier S, de Ligniéres B (апрель 1995 г.). «Влияние чрескожного введения эстрадиола и прогестерона на цикл эпителиальных клеток молочной железы человека in vivo». Fertil. Стерил. 63 (4): 785–91. Дои:10.1016 / S0015-0282 (16) 57482-2. PMID 7890063.
- ^ а б Спайсер Д.В., Урсин Г., Пайк М.С. (май 1996 г.). «Концентрации прогестерона - физиологические или фармакологические?». Fertil. Стерил. 65 (5): 1077–8. Дои:10.1016 / s0015-0282 (16) 58295-8. PMID 8612843.
- ^ Дж. М. Фойдарт; К. Колин; X. Denoo; J. D. Desreux; С. Фурнье; Б. де Линьер (1996). «Влияние чрескожного введения эстрадиола и прогестерона на пролиферацию эпителиальных клеток груди человека». У Ф. Кальво; М. Крепен; Х. Магделенат (ред.). Достижения в области биологии и терапии рака груди. Джон Либби Евротекст. С. 329–334. ISBN 9782742001385.
- ^ Фойдар Дж. М., Колин С., Дену Х, Дерё Дж., Бельяр А., Фурнье С., де Линьер Б. (май 1998 г.). «Эстрадиол и прогестерон регулируют пролиферацию эпителиальных клеток груди человека». Fertil. Стерил. 69 (5): 963–9. Дои:10.1016 / s0015-0282 (98) 00042-9. PMID 9591509.
- ^ а б c d de Lignières B, Silberstein S (апрель 2000 г.). «Фармакодинамика эстрогенов и прогестагенов». Цефалгия: международный журнал головной боли. 20 (3): 200–7. Дои:10.1046 / j.1468-2982.2000.00042.x. PMID 10997774. S2CID 40392817.
- ^ а б Шоу RW (ноябрь 1978 г.). «Нейроэндокринология менструального цикла человека». Клин Эндокринол Метаб. 7 (3): 531–59. Дои:10.1016 / S0300-595X (78) 80008-5. PMID 365398.
- ^ а б Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы ингибирования овуляции прогестинов: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция. 84 (6): 549–57. Дои:10.1016 / j.contraception.2011.04.009. PMID 22078182.
Таблица 1 Публикации по дозам прогестинов, подавляющих овуляцию: Прогестин: Прогестерон. Ссылка: Pincus (1956). Метод: мочевой прегнандиол. Суточная доза (мг): 300000. Общее количество циклов у всех субъектов: 61. Общее количество овуляции у всех субъектов: 30.% овуляции у всех субъектов: 49.
- ^ а б Камень, Авраам; Купперман, Герберт С. (1955). «Влияние прогестерона на овуляцию: предварительный отчет». Пятая Международная конференция по планированию отцовства: тема, перенаселенность и планирование семьи: отчет о заседаниях, 24-29 октября 1955 года, Токио, Япония. Международная федерация планируемого родительства. п. 185.
Представлены результаты тестирования влияния прогестерона на овуляцию у 13 пациенток в Исследовательском бюро Маргарет Сэнгер. У пациенток были нормальные менструальные циклы и явные признаки овуляции. Каждому пациенту давали 1000 мг [перорального] прогестерона ежедневно в течение среднего периода в течение 10 или 12 дней в течение 16 циклов. Овуляция подавлялась в 6 циклах. Нарушений менструального ритма не наблюдалось. 3 из 12 пациенток с длительным анамнезом бесплодия забеременели в течение 2-4 месяцев после прекращения терапии прогестероном.
- ^ а б С. Байер; Б. Дюстерберг; М. Ф. Эль Этреби; В. Элгер; Ф. Нойман; Ю. Нишино (1983). «Токсикология агентов, регулирующих гормональную фертильность». В Джузеппе Бенаджиано; Эгон Дицфалуси (ред.). Эндокринные механизмы в регуляции фертильности. Raven Press. С. 261–346. ISBN 978-0-89004-464-3.
- ^ Пинкус G (1956). «Некоторые эффекты прогестерона и родственных ему соединений на репродукцию и раннее развитие млекопитающих». Acta Endocrinol Suppl (Копен). 23 (Дополнение 28): 18–36. Дои:10.1530 / acta.0.023S018. PMID 13394044.
- ^ Pincus G (декабрь 1958 г.). «Гормональный контроль овуляции и раннего развития». Постградская медицина. 24 (6): 654–60. Дои:10.1080/00325481.1958.11692305. PMID 13614060.
Таблица 1: Влияние перорального прогестерона на три показателя овуляции: Лекарства: прогестерон. Число: 69. Средняя длина цикла: 25,5 ± 0,59. Процент положительных результатов на овуляцию по: Базальной температуре: 27. Биопсия эндометрия: 18. Влагалищный мазок: 6. [...] мы остановились на 300 мг. в день [пероральный прогерстерон] в качестве значительно эффективной дозы [подавления овуляции], и ее вводили с пятого по двадцать четвертый день менструального цикла. [...] Мы наблюдали за каждым из 33 добровольцев в течение контрольного цикла без лечения и в течение одного-трех последовательных циклов приема лекарств сразу после контрольного цикла. В качестве показателей наступления овуляции брали суточную базальную температуру и мазки из влагалища, а с девятнадцатого по двадцать второй день цикла - биопсию эндометрия. [...] Хотя таким образом мы продемонстрировали ингибирующую овуляцию активность прогестерона у нормально овулирующих женщин, пероральные препараты прогестерона имели два недостатка: (1) большая суточная доза (300 мг), которая, предположительно, должна быть еще больше, если стремились к 100-процентному подавлению1 [...]
- ^ а б Пинкус, Грегори (1959). Прогестивные агенты и контроль фертильности. Витамины и гормоны. 17. С. 307–324. Дои:10.1016 / S0083-6729 (08) 60274-5. ISBN 9780127098173. ISSN 0083-6729.
Ishikawa et al. (1957), применяя тот же режим введения прогестерона, также наблюдали подавление овуляции в части случаев, перенесших лапаротомию. Хотя субъекты наших экспериментов и Исикава и др. Практиковали половые сношения свободно, беременностей не наступило. Поскольку овуляция предположительно имела место в определенной пропорции циклов, отсутствие беременностей может быть вызвано случайностью, но Ishikawa et al. (1957) представили данные, свидетельствующие о том, что у женщин, получавших прогестерон внутрь, цервикальная слизь становится непроницаемой для сперматозоидов.
- ^ Рок Дж, Гарсия ЧР, Пинкус Джи (1957). «Синтетические прогестины в нормальном менструальном цикле человека». Недавняя прог. Horm. Res. 13: 323–39, обсуждение 339–46. PMID 13477811.
- ^ Тайлер ET, Олсон HJ (апрель 1959 г.). «Эффекты новых стероидных гормонов, стимулирующие и подавляющие фертильность». J Am Med Assoc. 169 (16): 1843–54. Дои:10.1001 / jama.1959.03000330015003. PMID 13640942.
- ^ Халлер, Дж. (1968). "Die antikonzeptionelle Therapie". Die Gestagene. С. 1125–1178. Дои:10.1007/978-3-642-99941-3_8. ISBN 978-3-642-99942-0.
- ^ Нойман Ф.В., Элгер Ю., Нишино Ю., Стейнбек Х (1977). "Probleme der Dosisfindung: Sexualhormone" [Проблемы определения дозы: половые гормоны]. Arzneimittel-Forschung [Исследования наркотиков]. 27: 296–318. ISSN 0004-4172.
- ^ Нойман Ф (1978). «Физиологическое действие прогестерона и фармакологические эффекты прогестагенов - краткий обзор». Postgrad Med J. 54 Дополнение 2: 11–24. PMID 368741.
- ^ Виктор А., Jackanicz TM, Johansson ED (декабрь 1978 г.). «Вагинальный прогестерон для контрацепции». Fertil. Стерил. 30 (6): 631–5. Дои:10.1016 / S0015-0282 (16) 43688-5. PMID 729823.
- ^ Croxatto HB, Díaz S (1987). «Место прогестерона в контрацепции человека». J. Стероид Биохим. 27 (4–6): 991–4. Дои:10.1016/0022-4731(87)90179-8. PMID 3320572.
- ^ Бэкстрём Т., фон Шульц Б., Тойвонен Дж. (1979). «Концентрации прогестерона в плазме после введения через интравагинальные кольца». Acta Obstet Gynecol Scand. 58 (2): 211–2. Дои:10.3109/00016347909154585. PMID 452876. S2CID 34956863.
- ^ Шаабан М.М. (1991). «Контрацепция с прогестагенами и прогестероном при кормлении грудью». J. Steroid Biochem. Мол. Биол. 40 (4–6): 705–10. Дои:10.1016 / 0960-0760 (91) 90294-Ф. PMID 1835650. S2CID 25152238.
- ^ Уодсворт П.Ф., Хейвуд Р., Аллен Д.Г., Хоссак Д.Д., Сортуэлл Р.Дж., Уолтон Р.М. (октябрь 1979 г.). «Лечение макак-резусов (Macaca mulatta) интравагинальными кольцами, пропитанными прогестероном или норэтистероном». Контрацепция. 20 (4): 339–51. Дои:10.1016 / с0010-7824 (79) 80044-х. PMID 116799.
- ^ Неттер А., Горинс А., Томас К., Коэн М., Жубино Дж. (1973). «Блокировка ЛГ и ФСГ в виде доз прогестерона, вызывающих у женщин» [пиковая блокада ЛГ и ФСГ низкими дозами экзогенного прогестерона у женщин]. Анна. Эндокринол. (Париж) (На французском). 34 (4): 430–5. ISSN 0003-4266. PMID 4779738.
- ^ Лобо, Роджерио А .; Станчик, Франк З. (1994). «Новые знания в физиологии гормональных контрацептивов». Американский журнал акушерства и гинекологии. 170 (5): 1499–1507. Дои:10.1016 / S0002-9378 (12) 91807-4. ISSN 0002-9378. PMID 8178898.
- ^ Толлан А., Оян П., Кьельдсен С.Э., Эйде I, Мальтау Дж. М. (1993). «Прогестерон снижает симпатический тонус без изменения артериального давления или баланса жидкости у мужчин». Гинеколь. Акушерство. Вкладывать деньги. 36 (4): 234–8. Дои:10.1159/000292636. PMID 8300009.
- ^ Прогестерон - Drugs.com, получено 2015-08-23
- ^ Йосимович Дж (11 ноября 2013 г.). Гинекологическая эндокринология. Springer Science & Business Media. С. 9, 25–29, 139. ISBN 978-1-4613-2157-6.
- ^ Джером Франк Штраус; Роберт Л. Барбьери (2009). Репродуктивная эндокринология Йена и Яффе: физиология, патофизиология и клиническое управление. Elsevier Health Sciences. С. 807–. ISBN 978-1-4160-4907-4.
- ^ Брэди Б.М., Андерсон Р.А., Киннибург Д., Бэрд Д.Т. (2003). «Демонстрация опосредованного рецептором прогестерона подавления гонадотропина у мужчин». Clin. Эндокринол. (Oxf). 58 (4): 506–12. Дои:10.1046 / j.1365-2265.2003.01751.x. PMID 12641635. S2CID 12567639.
- ^ а б c Хеллер К. Г., Мур Д. Д., Полсен Калифорния, Нельсон В. О., Лейдлоу В. М. (декабрь 1959 г.). «Влияние прогестерона и синтетических прогестинов на репродуктивную физиологию нормальных мужчин». Кормили. Proc. 18: 1057–65. PMID 14400846. Архивировано из оригинал на 2018-12-18. Получено 2018-12-18.
- ^ Ротшильд I (июнь 1957 г.). «Влияние больших доз внутривенно вводимого прогестерона на экскрецию гонадотропина у женщин». J. Clin. Эндокринол. Метаб. 17 (6): 754–9. Дои:10.1210 / jcem-17-6-754. PMID 13428841.
- ^ Вейн А.Дж., Кавусси Л.Р., Новик А.С., Партин А.В., Петерс Калифорния (25 августа 2011 г.). Урология Кэмпбелла-Уолша: Expert Consult Premium Edition: расширенные онлайн-функции и печать, набор из 4 томов. Elsevier Health Sciences. С. 2938–. ISBN 978-1-4160-6911-9.
- ^ Кьельд Дж. М., Пуах С. М., Кауфман Б., Лойзу С., Влотидес Дж., Гви Х. М., Кан Ф., Суд Р., Джоплин Г. Ф. (1979). «Влияние приема норгестрела и этинилэстрадиола на сывороточные уровни половых гормонов и гонадотропинов у мужчин». Клиническая эндокринология. 11 (5): 497–504. Дои:10.1111 / j.1365-2265.1979.tb03102.x. PMID 519881. S2CID 5836155.
- ^ а б Neumann, F .; Diallo, F.A .; Hasan, S.H .; Schenck, B .; Траоре, И. (1976). «Влияние фармацевтических соединений на мужскую фертильность *». Андрология. 8 (3): 203–235. Дои:10.1111 / j.1439-0272.1976.tb02137.x. ISSN 0303-4569. PMID 793446. S2CID 24859886.
- ^ Хеллер CG, Лейдлоу WM, Харви HT, Нельсон WO (июль 1958 г.). «Влияние прогестагенных соединений на репродуктивные процессы мужчины». Анна. Акад. Наука. 71 (5): 649–65. Дои:10.1111 / j.1749-6632.1958.tb54641.x. PMID 13583821. S2CID 32637425.
- ^ а б Нойман, Ф. (1985). «Стероидная контрацепция - экспериментальный фон». Будущие аспекты контрацепции: 129–144. Дои:10.1007/978-94-009-4910-2_2. ISBN 978-94-010-8675-2.
- ^ Бэйн, Дж. (1980). «Комбинации андрогенов и прогестинов: клинические испытания». Регулирование мужской фертильности: 85–91. Дои:10.1007/978-94-009-8875-0_9. ISBN 978-94-009-8877-4.
- ^ а б Petry, R .; Пфизенмайер, К. (1973). "Möglichkeiten der medikamentösen Fertilitätshemmung beim Mann". Deutsche Medizinische Wochenschrift. 98 (38): 1775–1779. Дои:10.1055 / с-0028-1107127. ISSN 0012-0472. PMID 4742513.
- ^ Sundsfjord JA, Aakvaag A, Norman N (август 1971 г.). «Снижение уровня тестостерона и ЛГ в плазме у молодых мужчин при приеме прогестерона». J. Reprod. Удобрение. 26 (2): 263–5. Дои:10.1530 / jrf.0.0260263. PMID 5558416.
- ^ а б Туркмен С., Бэкстрем Т., Вальстрем Г., Андрин Л., Йоханссон И.М. (2011). «Толерантность к аллопрегнанолону с акцентом на рецептор ГАМК-А». Br. J. Pharmacol. 162 (2): 311–27. Дои:10.1111 / j.1476-5381.2010.01059.x. ЧВК 3031054. PMID 20883478.
- ^ а б Follesa P, Concas A, Porcu P, Sanna E, Serra M, Mostallino MC, Purdy RH, Biggio G (2001). «Роль аллопрегнанолона в регуляции пластичности рецепторов ГАМК (А) во время длительного воздействия и отмены прогестерона». Brain Res. Brain Res. Rev. 37 (1–3): 81–90. Дои:10.1016 / s0165-0173 (01) 00125-4. PMID 11744076. S2CID 362309.
- ^ а б c Шиллер CE, Шмидт П.Дж., Рубинов Д.Р. (2014). «Аллопрегнанолон как медиатор аффективного переключения при расстройствах репродуктивного настроения». Психофармакология. 231 (17): 3557–67. Дои:10.1007 / s00213-014-3599-х. ЧВК 4135022. PMID 24846476.
- ^ а б c Бэкстрём Т., Хааге Д., Лёфгрен М., Йоханссон И.М., Стрёмберг Дж., Нюберг С., Андреен Л., Оссеваарде Л., ван Винген Г.А., Туркмен С., Бенгтссон С.К. (2011). «Парадоксальные эффекты модуляторов ГАМК-А могут объяснить симптомы негативного настроения, вызванные половыми стероидами, у некоторых людей». Неврология. 191: 46–54. Дои:10.1016 / j.neuroscience.2011.03.061. PMID 21600269. S2CID 38928854.
- ^ Андреен Л., Сундстрём-Поромаа I, Биксо М., Андерссон А., Нюберг С., Бэкстрём Т. (февраль 2005 г.). «Связь между аллопрегнанолоном и плохим настроением у женщин в постменопаузе, проходящих последовательную заместительную гормональную терапию вагинальным прогестероном». Психонейроэндокринология. 30 (2): 212–24. Дои:10.1016 / j.psyneuen.2004.07.003. PMID 15471618. S2CID 29760633.
дальнейшее чтение
- Sitruk-Ware R, Bricaire C, De Lignieres B, Yaneva H, Mauvais-Jarvis P (октябрь 1987 г.). «Пероральный микронизированный прогестерон. Фармакокинетика биодоступности, фармакологические и терапевтические последствия - обзор». Контрацепция. 36 (4): 373–402. Дои:10.1016/0010-7824(87)90088-6. PMID 3327648.
- Саймон Дж. А. (декабрь 1995 г.). «Микронизированный прогестерон: вагинальное и оральное применение». Клиническое акушерство и гинекология. 38 (4): 902–14. Дои:10.1097/00003081-199538040-00024. PMID 8616985.
- Руан Х, Муек А.О. (ноябрь 2014 г.). «Системная терапия прогестероном - пероральная, вагинальная, инъекционная и даже трансдермальная?». Maturitas. 79 (3): 248–55. Дои:10.1016 / j.maturitas.2014.07.009. PMID 25113944.
